第3节 硫的转化 知识点题库
实验 | 现象 | 结论 | |
A | 含HCl、BaCl2的FeCl3溶液 | 产生白色沉淀 | SO2有还原性 |
B | H2S溶液 | 产生黄色沉淀 | SO2有氧化性 |
C | 酸性KMnO4溶液 | 紫色溶液褪色 | SO2有漂白性 |
D | Na2SiO3溶液 | 产生胶状沉淀 | 酸性:H2SO3>H2SiO3 |
①Na2O2﹣供氧剂 ②晶体Si﹣太阳能电池 ③AgI﹣人工降雨 ④NaCl﹣制纯碱 ⑤Al2O3﹣焊接钢轨 ⑥NaClO﹣消毒剂⑦Fe2O3﹣红色油漆或涂料 ⑧SO2﹣食品漂白剂 ⑨NH3﹣制冷剂.
| 选项 | 相关实验 | 预期目的 |
| A | 将SO2通入溴水,溴水褪色 | 验证SO2的漂白性 |
| B | 将氯水加入KI-淀粉溶液中 | 验证Cl的非金属性比I强 |
| C | 将铁和锌置于稀硫酸中构成原电池 | 比较铁和锌的金属性强弱 |
| D | 检测熔融AlCl3的导电性 | 证明AlCl3是共价化合物 |
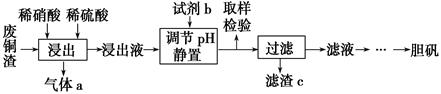
已知生成氢氧化物沉淀的pH如下表所示:
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀 | 4.2 | 6.5 | 1.5 |
| 完全沉淀 | 6.7 | 9.7 | 3.7 |
-
(1) 写出浸出时铜与稀硫酸、稀硝酸反应生成硫酸铜的化学方程式:。
-
(2) 取样检验是为了确认Fe3+是否除净,你的检验方法是。
-
(3) 试剂b是,滤渣c是(均写化学式)。
-
(4) 气体a可以被循环利用,用化学方程式表示气体a被循环利用的原理为2NO+O2=2NO2、。
-
(5) 一定温度下,硫酸铜受热分解生成CuO、SO2气体、SO3气体和O2气体,且n(SO3)∶n(SO2)=1∶2,写出硫酸铜受热分解的化学方程式:。
-
(6) 某同学设计了如下图所示的实验装置分别测定生成的SO2、SO3气体的质量和O2气体的体积。此设计有不合理之处,请说明理由:。


下列说法错误的是( )
| 实验操作 | 结论 | |
| A | 分别加入铁片 | 无气体产生者为浓硫酸 |
| B | 分别滴加到胆矾晶体中 | 晶体变白者为浓硫酸 |
| C | 分别滴加到pH试纸上 | 试纸变黑者为浓硫酸 |
| D | 将蘸有浓氨水的玻璃棒靠近酸的瓶口 | 有白烟生成的是浓硫酸 |
-
(1) 在一定条件下一氧化碳可将二氧化硫还原为单质硫。已知:
①C(s)+O2(g)
 CO2(g) ΔH=-393.5kJ·mol-1
CO2(g) ΔH=-393.5kJ·mol-1②CO2(g)+C(s)=2CO(g)ΔH=+172.5kJ·mol-1
③S(s)+O2(g)=SO2(g)ΔH=-296.0kJ·mol-1
反应2CO(g)+SO2(g)=S(s)+2CO2(g)ΔH=kJ·mol-1
-
(2) 石灰石-石膏脱硫有干法和湿法两种,其原理为利用石灰石作原料在不同条件下吸收SO2转化为石膏。
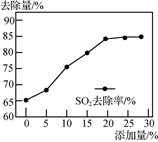
①干法脱硫的效率受添加助剂(由多种天然矿物配比而成的,价格较贵)的影响。脱硫效率随助剂的添加量变化如图所示。助剂适宜添加量为%,理由是。
②湿法脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需先通一段时间二氧化碳,以增加其脱硫效率,理由是。
-
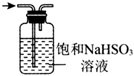
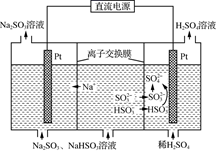
(3) 工业上可用Na2SO3溶液吸收烟气中的二氧化硫,所得吸收液进行电解循环再生,如下图所示。写出阳极的电极反应式(任写一个)。
-
(4) 已知25℃时,NH3·H2O的Kb=1.8×10-5 , H2SO3的Ka1=1.3×10-2 , Ka2=6.2×10-8。若氨水的浓度为2mol·L-1 , 则溶液中c(OH-)=。将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol·L-1时,溶液中的
 =。
=。
 SO2
SO2  CaSO4
B . 粗Si
CaSO4
B . 粗Si  SiHCl3
SiHCl3  纯Si
C . Mg
纯Si
C . Mg  Mg3N2
Mg3N2  MgO
D . N2
MgO
D . N2  NH3
NH3  NO
NO  HNO3
HNO3
已知: 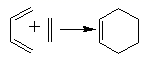
回答下列问题:
-
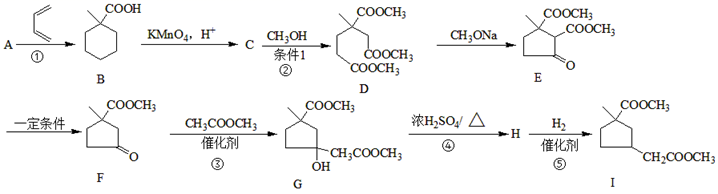
(1) A的名称为;C的结构简式;E的官能团名称为。
-
(2) 反应③的化学反应类型为;④中浓硫酸的作用是。
-
(3) 写出反应⑤可能的化学方程式(写出一个方程式即可)。
-
(4) 写出满足下列条件
 的同分异构体的结构简式。(写两个)
的同分异构体的结构简式。(写两个) ①含有六元含氮杂环;②无N-N键;③1H-NMR谱显示分子中含有4种氢原子。
-
(5) 参照上述合成路线和信息,以丙烯为原料合成化合物
 的路线流程图(无机试剂任用,流程图形式见题干)。
的路线流程图(无机试剂任用,流程图形式见题干)。
| 选项 | A | B | C | D |
| 装置 | | | | |
| 目的 | 分离NaCl和I2的固体混合物 | 分离Fe(OH)3胶体中的FeCl3 | 除去CO2中混有的SO2 | 用乙醇萃取碘水中的碘并分离 |
 、
、  ⇌H++
⇌H++  D . 取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
D . 取出试管中溶液,在空气中放置一段时间后pH下降,是由于SO2挥发
 和
和 的比较不正确的是( )
的比较不正确的是( )
 溶液褪色
D . 两者都具有氧化性
溶液褪色
D . 两者都具有氧化性
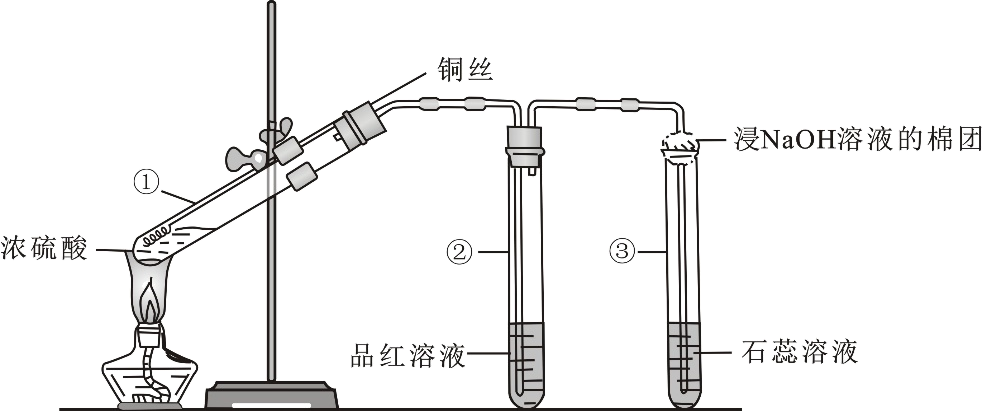
请回答:
-
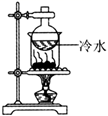
(1) ①铜丝的底端设计成螺旋状,其优点是:
②浸有NaOH溶液的棉团的作用是:
-
(2) 下列有关实验现象和操作正确的是____A . ②试管中的品红溶液红色褪去 B . ③试管中的石蕊溶液先变红后褪色 C . 实验完成后先停止加热,再断开连接处的橡胶管 D . 实验完成后,将①试管中的物质慢慢倒入少量水中,得到蓝色溶液
-
(3) 该同学查阅资料发现:硫酸铜可加快稀硫酸与锌粒的反应速率,欲通过变量控制法设计以下实验进行探究。
A组
B组
1.0mol•L‾1H2SO4/mL
20
V1
1.2mol•L‾1CuSO4溶液/mL
0
5
H2O/mL
V2
0
形状、大小几乎相同的Zn粒
3粒
3粒
①请完成此实验设计,其中:V1=,V2=。
②实验过程中发现B组溶液蓝色变浅,且Zn粒表面有红色物质析出,产生H2速度大于A组,下列解释合理的是。
A.Zn置换出铜,形成原电池,加快了反应速度
B.硫酸根浓度增加,加快了反应速度
C.铜、锌同时与硫酸反应置换出H2 , 加快了反应速度