主题1 物质的分离 知识点题库

-
(1) “加压硫酸浸出”过程中会发生以下化学反应:
Cu2Te+2O2=2CuO+TeO2;TeO2+H2SO4=TeOSO4+H2O
①Ag2Te也能与O2发生类似Cu2Te的反应,化学方程式为.
②工业上给原料气加压的方法是.
-
(2) 操作Ⅰ是.
-
(3) “含碲浸出液”的溶质成分除了TeOSO4外,主要是(填化学式).
-
(4) “电解沉积除铜”时,将“含碲浸出液”置于电解槽中,铜、碲沉淀的关系如图2.电解初始阶段阴极的电极反应式是.
-
(5) 向“含碲硫酸铜母液”通入SO2并加入NaCl反应一段时间后,Te(IV)浓度从6.72g•L﹣1下降到0.10g•L﹣1 , Cu2+浓度从7.78g•L﹣1下降到1.10g•L﹣1 .
①TeOSO4生成Te的化学方程式为.
②研究表明,KI可与NaCl起相同作用,从工业生产的角度出发选择NaCl最主要的原因是
③计算可得Cu2+的还原率为85.9%,Te(IV)的还原率为.

请回答下列问题:
-
(1) 第Ⅰ步中,载体Al2O3不与稀硝酸反应.Ag和稀硝酸反应产生的气体是
-
(2) 第Ⅱ步中,饱和食盐水由工业食盐水提纯而得.除去工业食盐水中的少量Na2SO4、MgCl2、CaCl2杂质,正确的操作顺序是(填字母编号).
a.加入稍过量的NaOH溶液 b.加入稍过量的BaCl2溶液 c.过滤
d.加入稍过量的Na2CO3溶液 e.加入适量盐酸
-
(3) 第III步中,加入氨水使沉淀溶解的离子方程式是
-
(4) N2H4具有还原性,氧化产物为N2 . 第IV步反应的产物除Ag和N2外,还有的物质是(填化学式).
-
(5) N2H4可用作火箭推进剂.已知:
N2H4(1)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣116kJ/mol
N2(g)+O2(g)=2NO(g)△H=+183kJ/mol
N2H4和NO2反应生成N2和气态H2O的热化学方程式是.
-
(6) Ag可制备银锌纽扣电池正极材料Ag2O2 , 碱性条件下该电池的正极反应式是.
-
(7) 若上述流程中第Ⅰ、Ⅱ、Ⅲ步银的回收率均为90%,则处理以a kg含银b%的废银催化剂,理论上需要加入N2H4的质量是 kg.

请回答下列问题:
-
(1) 配制氯化铁浸渍液时要求pH为0.8~1之间,pH太高则,pH太低,浸渍矿石会产生有害气体,操作①是.由氯化锌溶液制备氯化锌晶体的方法是.
-
(2) 高沸点溶剂R﹣4E几乎不溶于水,120℃时硫在R﹣4E里的溶解度为365g,室温时溶解度为35.9g,从浸出液B提取硫的方法是.硫是工业制备硫酸的原料,现有1吨矿石,硫的总含量为24%,最多制备浓度98%的硫酸吨.
-
(3) 氯化铁与硫化锌发生反应:2FeCl3+ZnS═ZnCl2+2FeCl2+S,则氯化铁与FeS反应的方程式为.
-
(4) 溶液X的成分的化学式为,该流程中循环使用的物质是.
-
(5) 由氯化亚铁溶液制备氯化铁溶液,可以用H2O2、Cl2 , 但生产成本高.酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为.
 C .
C .  D .
D . 
 B . 用装置乙吸收NH3制取Al(OH)3
B . 用装置乙吸收NH3制取Al(OH)3  C . 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌
C . 用装置丙分离Al(OH)3和NH4Cl溶液时,用玻璃棒不停的在漏斗内搅拌 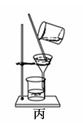 D . 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl
D . 用装置丁蒸干NH4Cl溶液并灼烧制NH4Cl 

已知:①反应Ⅰ的化学方程式:MnO2+SO2=MnSO4;
②MnCO3、Mn(OH)2均难溶于水,MnCO3在100℃时开始分解。
回答下列问题:
-
(1) MnCO3的摩尔质量为。
-
(2) 反应Ⅱ的化学方程式为。
-
(3) 流程中“操作”的名称为,所需要的主要玻璃仪器有。
-
(4) MnCO3粗产品表面附着有Na2SO4杂质,请设计实验验证杂质洗涤干净的方法 。
-
(5) 为获得高纯MnCO3 , 需选择“低温”干燥的原因是。

 C . ③:分离乙酸乙酯和饱和碳酸钠溶液
D . ④:除去C2H6中含有的C2H4
C . ③:分离乙酸乙酯和饱和碳酸钠溶液
D . ④:除去C2H6中含有的C2H4
-
(1) 制法一:将80%醋酸用水稀释后,水浴加热至60~ 80℃,在搅拌下分批少量加入碳酸镁至CO2不再逸出为止,继续加热,趁热过滤。在滤液中补充适量醋酸,……,得到四水醋酸镁晶体,……,即得无水醋酸镁,碳酸镁需分批少量加入,理由是。
-
(2) 滤液中补充适量醋酸的目的是。
-
(3) 从下列提供的操作中选择必要的操作(可重复使用),将制法一中“……”处的步骤补充完整,正确的顺序是 ,。 (填编号)

-
(4) 制法二 :将六水硝酸镁与醋酸酐混合加热,发生反应:(具体步骤略去)
2Mg(NO3)2•6H2O+ 14(CH3CO )2O
 2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH
2Mg(CH3COO )2+ 4NO 2↑+ O2↑+24CH3COOH用七水硫酸镁代替六水硝酸镁按相同操作进行制备实验,无法得到产品,原因是 。
-
(5) 以铬黑T(BET)为指示剂 ,用 EDTA测定Mg2+含量的原理用方程式可表示为:
EDTA (无色)+Mg-BET (紫红)= BET (蓝色)+ Mg-EDTA (无色)
为测定产品纯度,称取试样0.3000 g 于锥形瓶中,加入100ml 蒸馏水,待完全溶解后加入l 0mLpH=l 0的氨-氯化铁缓冲溶液,溶液变浑浊,再滴加3~ 4 滴铬黑 T 指示剂 (BET),用0.1000mol∙L-1 的 EDTA标准溶液滴定至终点,重复上述操作两次平均消耗 EDTA 标准溶液 20.50mL。
①滴定终点的现象为 。
②产品中镁元素的质量分数为(保留四位有效数字)。
-
(6) 下列关于该实验的操作或分析 ,正确的是__________(填编号)。A . 用倾析法将固液混合物转移至布氏漏斗中进行抽滤时,先转移溶液再转移沉淀 B . 称取一定质量的产品时,若电子天平未调整水平,则称得的产品偏多 C . 开始滴定前,滴定管尖悬挂的液滴需擦去,否则可能引起结果偏低 D . 根据(5)的测定方法可知,Mg(OH)2可溶于EDTA溶液
-
(1) I.化学试剂的妥善保存十分重要。共价化合物A由三种常见的短周期元素组成,常温常压下是一种有特殊气味的无色液体,易与强氧化剂反应,实验室必须密封避光保存。按以下流程进行实验(以下反应都为充分反应、气体F溶于水部分忽略不计):
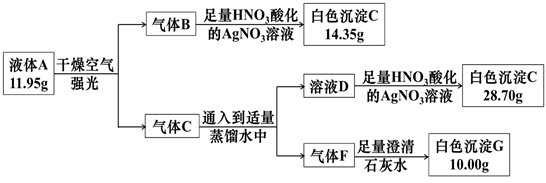
组成A的元素的元素符号为;G的化学式为。
-
(2) 液体A反应生成B和C的化学方程式为。
-
(3) 保存A时常加入1%的乙醇来破坏A被氧化生成的剧毒物质C。请写出C与乙醇反应生成碳酸二乙酯的化学方程式。
-
(4) II.Na2S2O3 , 又名大苏打、海波,可用以除去自来水中的多余氯气。在实验室可以用新制氯水模拟含多余氯气的自来水,向新制氯水中滴入Na2S2O3溶液。
新制氯水与Na2S2O3溶液反应的离子方程式为。
-
(5) 新制氯水中的氯气被全部除尽后,如果继续滴入Na2S2O3溶液有可能产生的现象:。
-
(1) Ⅰ.为探究SO2气体的还原性,某实验小组的同学利用如下图所示装置进行实验。
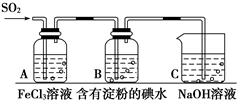
装置A中发生反应的离子方程式为。
-
(2) 装置C的作用是。
-
(3) 在上述装置中通入过量的SO2 , 为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液少量,分成两份,并设计了如下实验方案:
方案①:向第一份溶液中加入少量酸性KMnO4溶液,发现紫红色褪去;
方案②:向第二份溶液中加入少量KSCN溶液,发现不变红,再加入少量新制的氯水,溶液变红。上述方案中不合理的是,原因是。
-
(4) Ⅱ.无水FeCl3在空气中易潮解,遇水水解,加热易升华。实验室可用下列装置制备。
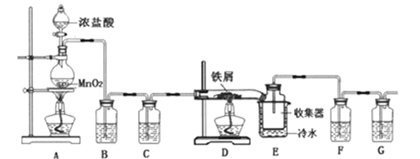
反应开始后,装置D硬质玻璃管中出现的现象为。
-
(5) 装置F中所盛的试剂为。
-
(6) 下列有关该实验的说法中,错误的是___________A . B装置的作用是除去HCl,并能减少Cl2的溶解 B . E装置中冷水的作用是冷却,使FeCl3冷却沉积 C . 若氯气不足则会产生FeCl2 D . 向烧瓶中加入足量的AgNO3和稀硝酸,可确定生成的MnCl2的质量
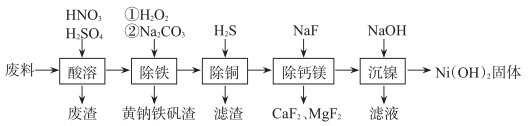
已知:H2S的电离常数K1=1.3×10-7 , K2=7.1×10-15;Ksp[CuS]=6.0×10-36;Ksp[Ni(OH)2]=1.0×10-15.6
回答下列问题:
-
(1) 合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,还原产物为N2 , 金属镍溶解的离子方程式是;“酸溶”时产生的废渣主要成分为。
-
(2) “除铁”加入Na2CO3时,生成黄钠铁矾(NaFe3(SO4)2(OH)6)的离子方程式是;“除铁”时,将“铁”转化成颗粒较大的黄钠铁矾沉淀对后续操作较为有利,原因是。
-
(3) “除铜”时,反应的离子方程式为H2S+Cu2+=CuS↓+2H+ , 该反应平衡常数K=。
-
(4) “除钙镁”过程在陶瓷容器中进行,NaF的实际用量为理论用量的1.1倍,用量不宜过大的原因是。
-
(5) “沉镍”前c(Ni2+)=1.0mol/L,加入少量浓NaOH溶液,若忽略加入浓NaOH溶液对溶液体积的影响,则开始沉淀时溶液的pH=。
-
(6) 用含镍21%的100kg铁镍合金废料经上述工艺制得31kgNi(OH)2固体,镍的回收率为。

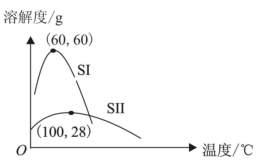
已知:通过合理控制浓缩后溶液的体积可得到外观不同的产品:当浓缩后溶液的体积较多时,易得到灰蓝色针状晶体K2[Cu(C2O4)2]·2H2O(简称SI),反之得到深蓝色片状晶体K2[Cu(C2O4)2]·H2O(简称SII)。
-
(1) 步骤①溶解过程中加入乙醇的目的是。
-
(2) 下列说法错误的是___。A . 步骤②煮沸的目的是除去溶液中的乙醇,防止乙醇与黑色固体发生氧化反应 B . 为提高原料的利用率,可将洗涤后的黑色固体连同滤纸一起加入到热的K2C2O4和KHC2O4混合液中 C . 步骤③为防止抽滤时滤纸破裂,可适当关小水龙头 D . 步骤④、⑤两次洗涤目的相同
-
(3) 移液管可准确移取实验所需的10mL3mol/LNaOH溶液,从下列选项中选出合理操作并排序:取一支10.00mL规格的已润洗移液管,用右手拇指及中指捏住管颈标线以上的地方,左手拿洗耳球轻轻将溶液吸上,。
a.取出移液管,用滤纸拭干移液管下端及外壁
b.当液面上升到标线以上1~2cm时,迅速用右手食指堵住管口
c.将移液管出口尖端与接受器壁接触
d.容器稍稍倾斜,移液管直立,使溶液顺壁流下
e.稍稍松开右手食指,使凹液面与标线相切
f.移液管稍稍倾斜,容器直立,使溶液顺壁流下
-
(4) 步骤⑤为得到较纯净的SI晶体,结合如图两种晶体在不同温度下的溶解度曲线,设计相关实验方案:。
-
(5) 某同学为测定胆矾的利用率(利用率=实际转化为最终产品物质的量/投料物质的量),进行了如下操作:将所得产品用20.00mLNH4Cl—NH3·H2O缓冲溶液溶解,加入指示剂,用0.1000mol/L的EDTA(Na2H2Y)标准溶液滴定至终点(EDTA能与大多数过渡金属元素的离子发生反应,如Cu2++H2Y2-=CuY2-+2H+),消耗EDTA标准溶液20.00mL;则该实验胆矾的利用率是。
 是无公害型冷却水系统的金属腐蚀抑制剂,工业上利用钼精矿(主要成分是不溶于水的
是无公害型冷却水系统的金属腐蚀抑制剂,工业上利用钼精矿(主要成分是不溶于水的 , 含少量
, 含少量 等)制备钼酸钠的工艺如图所示。
等)制备钼酸钠的工艺如图所示。
回答下列问题:
-
(1)
 中钼元素的化合价是。
中钼元素的化合价是。
-
(2) “焙烧”时空气从炉底进入,矿石经粉碎后从炉顶进入,这样处理的目的是,“焙烧”时
 , 转化为
, 转化为 , 反应的化学方程式为。
, 反应的化学方程式为。
-
(3) 碱浸”所得
 溶液中含
溶液中含 杂质,其中
杂质,其中 ,
,  , 在结晶前需加入
, 在结晶前需加入 固体以除去溶液中的
固体以除去溶液中的 。当
。当 开始沉淀时,
开始沉淀时, 的去除率是。[
的去除率是。[ , 溶液体积变化忽略]。
, 溶液体积变化忽略]。
-
(4) “重结晶”的具体操作为。
-
(5) 另一种利用钼精矿制备钼酸钠的工艺流程中,直接向粉碎后的钼精矿中加入
 溶液和
溶液和 溶液来得到钼酸钠,反应的离子方程式为,该工艺的优点是。(任写一条)
溶液来得到钼酸钠,反应的离子方程式为,该工艺的优点是。(任写一条)
-
(6)
 可充电电池的工作原理为:
可充电电池的工作原理为: , 则电池充电时阳极的电极反应式为。
, 则电池充电时阳极的电极反应式为。



