第二章 海水中的重要元素——钠和氯 知识点题库
-
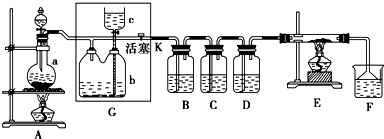
(1) 若A中烧瓶中的固体为MnO2 , 液体为浓盐酸,则其发生反应的化学方程式为.
-
(2) G中b瓶内宜加入的液体是
-
(3) 实验开始后B中反应的离子方程式是,
-
(4) C中的现象是
-
(5) E装置中硬质玻璃管内盛有炭粉,若E中发生氧化还原反应,其产物为二氧化碳和氯化氢,写出E中反应的化学方程式:.
-
(6) F中发生氧化还原反应的离子方程式:.
-
(1) 某同学分析产生上述现象的原因可能有两种,
①是氯水中的H+中和氢氧化钠溶液中的OH﹣ , 使溶液显酸性,溶液变无色②是氯水中的次氯酸氧化酚酞,导致酚酞分子结构被破坏,溶液褪色(即漂白而褪色)
你认为是哪种原因(填①或②)
-
(2) 请设计一个较简单的实验证明你的结论..
-
(1) 化学是一门以实验为基础的学科,化学所取得的丰硕成果与实验的重要作用分不开。结合下列实验装置图回答问题:
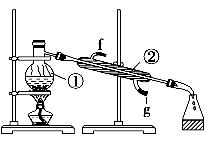
写出上图中所示仪器的名称:①;②。
-
(2) 若利用该装置分离乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为;实验时仪器②中冷却水的进口为(填“f”或“g”)。
-
(3) 应用上述分离操作,首先得到的物质是。
-
(4) 蒸馏烧瓶内碎瓷片的作用是。
-
(5) 硫酸试剂瓶标签上的内容:
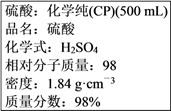
该硫酸的物质的量浓度是mol·L-1。
-
(6) 某化学兴趣小组进行硫酸性质的实验探究时,需要240 mL 4.6 mol·L-1的稀硫酸,则配制稀硫酸时需要取mL的该硫酸;配制时需选用的仪器主要有量筒、烧杯、玻璃棒、、(在横线上填写所缺仪器的名称)。
-
(7) 配制过程中,下列操作会使配制的稀硫酸溶液浓度偏高的是(填序号)。
①量取浓硫酸的量筒用蒸馏水洗涤2~3次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液并定容
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
 X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
X+Y+H2O(未配平,反应条件略去),其中A、B的物质的量之比为了1:4。请回答:
-
(1) 若Y是黄绿色气体,则Y的电子式是,该反应的离子方程式是。
-
(2) 若A为非金属单质,构成它的原子核外最外层电子数是次外层电子数的2倍,B的溶液为某浓酸,则反应中氧化剂与还原剂的物质的量之比是.
-
(3) 若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①元素在周期表中的位置是(填所在周期和族);Y的化学式是。
②含amol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,则被还原的X是mol。
-
(4) 若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4恰好反应后,溶液中离子浓度从大到小的顺序是。

(已知:  、
、  )
)
下列分析不正确的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 加快O2的生成速率 | 在过氧化氢溶液中加入少量MnO2 |
| B | 制取并纯化氯气 | 常温下向MnO2中滴加浓盐酸,将生成的气体依次通过浓硫酸和饱和食盐水 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 |
| D | 验证Cu和浓硫酸反应生成CuSO4 | 向反应后的溶液中加水,观察溶液变蓝色 |
 的性质。下列说法正确的是( )
的性质。下列说法正确的是( ) 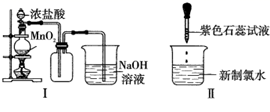

 过量,则浓盐酸可全部消耗完
B . Ⅱ图:证明新制氯水具有酸性和漂白性
C . Ⅲ图:证明Cl2具有强氧化性
D . Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气在光照条件下溶解度下降而逸出
过量,则浓盐酸可全部消耗完
B . Ⅱ图:证明新制氯水具有酸性和漂白性
C . Ⅲ图:证明Cl2具有强氧化性
D . Ⅳ图:日光照射烧瓶中的饱和氯水会有气泡产生,这是由于氯气在光照条件下溶解度下降而逸出
①标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
②同温同压下,体积相同的氢气和氩气所含的分子数相等
③1L 2mol/L的氯化镁溶液中含氯离子为4NA
④标准状况下22.4LH2O中分子数为NA
⑤32g O2和O3混合气体中含有原子数为2NA
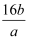 mol -1
B .
mol -1
B .  mol -1
C .
mol -1
C . 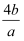 mol -1
D .
mol -1
D . 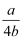 mol -1
mol -1
| 选项 | 实验组 | 实验操作 | 实验现象及结论 |
| A | 实验3-1 | 从煤油中取出金属钠,用滤纸吸干表面的煤油,用小刀切一小块金属钠,观察 | 钠的质地较软,有银白色金属光泽,一会儿后变暗,钠具有强还原性 |
| B | 实验3-2 | 另取一小块钠,用滤纸吸干金属钠表面的煤油,再放入坩埚中加热 | 钠迅速熔化,剧烈反应,钠的熔点低,生成物为淡黄色固体 |
| C | 科学探究 | 用坩埚钳夹住一块铝箔,在酒精灯上加热至熔化,轻轻晃动 | 金属铝熔化,但不滴落,铝的熔点比氧化铝的熔点高 |
| D | 实验3-3 | 将一小块钠放入滴有酚酞的水中 | 钠浮在水面,四处游动,溶液变红,金属钠与水反应生成碱性物质 |
 H2O + Cl2↑
H2O + Cl2↑
 在空气中加热可得固体
在空气中加热可得固体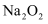 D . 工业制盐酸需要的HCl是通过氢气和氯气在光照条件下生成的
D . 工业制盐酸需要的HCl是通过氢气和氯气在光照条件下生成的



