第二章 海水中的重要元素——钠和氯 知识点题库
亚硝酰氯(ClNO)常用作催化剂和合成洗涤剂,其沸点为-5.5℃,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,进行如下实验(夹持装置略去)。请回答:
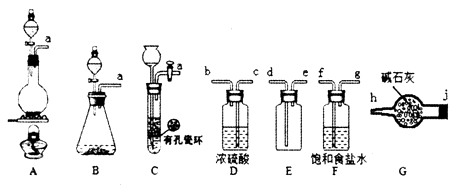
Ⅰ.Cl2的制备
-
(1) Cl2的发生装置可以选择上图中的(填大写字母),反应的离子方程式为.
-
(2) 欲收集一瓶干燥的氯气,选择上图中的装置,其连接顺序为:a
 (按气流方向,用小写字母表示)。
(按气流方向,用小写字母表示)。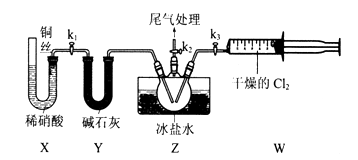
-
(3) Ⅱ.亚硝酰氯(ClNO)的制备。实验室可用下图装置制备亚硝酰氯(ClNO);
实验室也可用B装置制备NO,与之相比X装置的优点为.
-
(4) 在检查完装置气密性,并装入药品后,打开k2,然后再打开(填“k1”"或“k3”),通入一段时间气体,其目的为。接下来,两种气体在Z中反应,当有一定量液体生成时,停止实验。
-
(5) Ⅲ.亚硝酰氯(ClNO)纯度的测定
取Z中所得液体mg溶于水,配制成250mL溶液;取出25.00mL,以K2CrO4。溶液为指示剂,用c mol/LAgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体)
亚硝酰氯(ClNO)与水反应的化学方程式为.
-
(6) 亚硝酰氯(ClNO)的质量分数为(用代数式表示即可)。
化学探究学习小组的同学用下图所示装置制取氯气并探究氯气的某些性质。

-
(1) 装置A中制取Cl2的化学方程式为。
-
(2) 装置C中发生反应的离子方程式为,反应后溶液中含Cl元素的分子有。
-
(3) 实验结束后,测得装置D溶液中存在大量SO42-。Cl2通过装置D溶液时发生反应的离子方程式为 。
-
(4) 装置F的作用是,该装置中发生反应的离子方程式。
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A . 常温常压下,36g18O2中所含的中子数为16NA
B . 8.0 g Cu2S和CuO的混合物中含有的铜原子数为0.1NA
C . 电解饱和食盐水时,阳极生成22.4L气体时,转移的电子数为2NA
D . 室温下向1LpH=1的醋酸溶液中加水,所得溶液中H+数目小于0.1NA
化学中常用类比的方法可预测许多物质的性质.如根据H2+Cl2=2HCl推测:H2+Br2=2HBr.但类比是相对的,如根据2Na2O2+2CO2=Na2CO3+O2 , 类推2Na2O2+2SO2=Na2SO3+O2是不符合题意的,应该是Na2O2+SO2=Na2SO4 . 下列各组类比中正确的是()
A . 钠与水反应生成NaOH和H2 , 推测:所有金属与水反应都生成碱和H2
B . Na2CO3+2HCl=2NaCl+H2O+CO2↑,推测:Na2SO3+2HCl=2NaCl+H2O+SO2↑
C . CO2+Ca(ClO)2+H2O=CaCO3↓+2HClO,推测:2SO2+Ca(ClO)2+H2O=CaSO3↓+2HClO
D . 铝和硫直接化合能得到Al2S3 , 推测:铁和硫直接化合也能得到Fe2S3
下列关于碳酸钠和碳酸氢钠的比较中,错误的是( )
A . 二者在水中的溶解度不同,碳酸氢钠的溶解度小于碳酸钠
B . 二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠
C . 二者都能与盐酸反应放出二氧化碳气体,二者等质量与足量盐酸反应时生成CO2量一样多
D . 二者在一定条件下可以相互转化
一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是( )
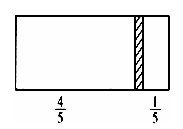
A . 右边CO与CO2分子数之比为1:3
B . 右侧CO的质量为14g
C . 右侧气体密度是相同条件下氧气密度的2倍
D . 若改变右边CO和CO2的充入量而使隔板处于距离右端1/3处,保持温度不变,则前后两次充入情况容器内的压强之比为5: 6
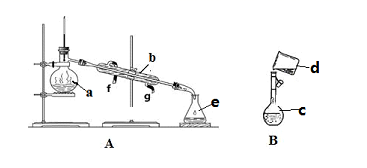
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
-
(1) 写出下列仪器的名称:a.,
B.,
C.。
-
(2) 若利用装置分离酒精和水的混合物,还缺少的仪器是,冷凝水由口流出(填f或g)。
-
(3) 现需配制0.1mol/LNaOH溶液450mL,装置B是某同学转移溶液的示意图。
①图中的错误是。
②根据计算得知,所需NaOH的质量为。
化学与我们的日常生活密切相关。按要求回答以下问题:
-
(1) 明矾可用作净水剂,其化学式是,漂白粉的有效成分是 (填化学式)。
-
(2) 光导纤维在强碱性条件下容易发生“断路”,用离子方程式解释其原因
-
(3) 小苏打通常用来治疗胃酸过多,但同时患有胃溃疡的病人却不能服用,其原因是(用化学方程式表示)。
-
(4) SO2和氯水都有漂白性,将SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
铋酸钠(NaBiO3) 是分析化学中的重要试剂,不溶于冷水,遇沸水或酸则迅速分解。某化学兴趣小组设计下图实验装置制取铋酸钠。装置丙中盛有Bi(OH)3(难溶于水) 与NaOH溶液混合物。下列说法错误的是( )

A . 装置乙中盛装的试剂是饱和食盐水
B . 装置丙中发生反应的离子方程式是:Bi(OH)3+3OH-+Na++Cl2=NaBiO3+2Cl-+3H2O
C . 从装置丙中获得产品的操作为:在冰水中冷却结晶、过滤、洗涤、干燥
D . 为除去所得固体中混有的Bi(OH)3 , 可用稀盐酸洗涤
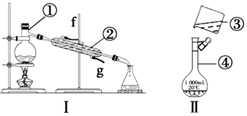
根据如图所示实验装置,回答下列问题。
-
(1) 写出下列仪器的名称:①,④。
-
(2) 仪器①~④中,使用时必须检查是否漏水的是(填序号)。
-
(3) 若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器是,②的进水口是(填“f”或“g”)。
-
(4) 配制溶液时,下列操作会导致所配溶液的浓度偏低的是(填标号)。
a.洗涤烧杯和玻璃棒的溶液未转移入容量瓶中
b.定容时,眼睛俯视使溶液凹面最低点与容量瓶刻度线相切
c.容量瓶中原残留有少量蒸馏水
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
若镁原子质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法错误的是( )
A . 该镁原子的相对原子质量是  B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是
B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是  mol
D . Wg该镁原子所含质子数是
mol
D . Wg该镁原子所含质子数是 
 B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是
B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是  mol
D . Wg该镁原子所含质子数是
mol
D . Wg该镁原子所含质子数是 
中国药学家屠呦呦因发现青蒿素开创了治疗疟疾的新方法,荣获了诺贝尔奖。第十三届全国人民代表大会常务委员会第十三次会议决定授予屠呦呦“共和国勋章”,表彰他及其团队为新中国建设和发展作出的杰出贡献。已知青蒿素的分子式为C15H22O5 , 下列有关说法正确的是( )
A . 青蒿素的摩尔质量为282g/mol
B . 青蒿素中C,H,O的质量之比为15:22:5
C . 标准状况下,1mol青蒿素的体积约为22.4L
D . 1mol青蒿素中含11molH2
-
(1) 2 mol O3和3 mol O2的质量之比为,同温同压下的密度之比为,含氧原子数之比为。
-
(2) 在标准状况下,由CO和CO2组成的混合气体6.72 L,质量为12 g。此混合物中CO和CO2分子数目之比是,混合气体的平均摩尔质量是。
-
(3) 气体化合物A的化学式可表示为OxFy,已知同温同压下10 mL A受热分解生成15 mL O2和10 mL F2,则A的化学式为,推断的依据是。
-
(4) 在标准状况下,15.6 g Na2O2投入足量水中,可产生O2的体积为。
-
(5) 标准状况下有①0.112 L水、②3.01×1023个HCl分子、③13.6 g H2S气体、④0.2 mol氨气、⑤2 mol氦气、⑥6.02×1023个白磷(P4)分子,所含原子个数从大到小的顺序为。
标准状况下V L氨气溶解在1 L水中(水的密度为1 g·mL-1),所得溶液的密度为ρ g·mL-1 , 质量分数为w,物质的量浓度为c mol·L-1 , 则下列关系中正确的是( )
A . ρ= 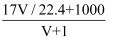 B . w=
B . w=  %
C . w=
%
C . w= 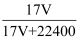 D . c=
D . c= 
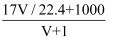 B . w=
B . w=  %
C . w=
%
C . w= 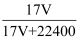 D . c=
D . c= 
下列表述正确的是( )
A . 硅晶体具有半导体性能,可用于光导纤维
B . 碳酸钠可用于去除餐具的油污
C . 次氯酸是一种弱酸是因为次氯酸不稳定,易分解
D .  能使酸性
能使酸性  溶液褪色,体现了
溶液褪色,体现了  的漂白性
的漂白性
 能使酸性
能使酸性  溶液褪色,体现了
溶液褪色,体现了  的漂白性
的漂白性
已知 是阿伏加德罗常数的值,下列说法错误的是( )
是阿伏加德罗常数的值,下列说法错误的是( )
 是阿伏加德罗常数的值,下列说法错误的是( )
是阿伏加德罗常数的值,下列说法错误的是( )
A . 标准状况下, 含有的
含有的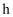 数为
数为 B .
B . 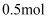 熔融
熔融 中含有的
中含有的 数为
数为 C .
C .  与足量盐酸反应,转移的电子数为
与足量盐酸反应,转移的电子数为 D . 标准状况下,
D . 标准状况下,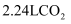 和
和 的混合气体中分子数为
的混合气体中分子数为
 含有的
含有的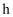 数为
数为 B .
B . 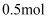 熔融
熔融 中含有的
中含有的 数为
数为 C .
C .  与足量盐酸反应,转移的电子数为
与足量盐酸反应,转移的电子数为 D . 标准状况下,
D . 标准状况下,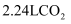 和
和 的混合气体中分子数为
的混合气体中分子数为
下列说法正确的是( )
A . 钠在氧气中燃烧生成过氧化钠,则锂在氧气中燃烧也生成过氧化锂
B .  的分子构型为直线形,则
的分子构型为直线形,则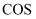 分子构型也为直线形
C . 碳酸钠溶于水放出热量,则碳酸氢钠溶于水也是放出热量
D .
分子构型也为直线形
C . 碳酸钠溶于水放出热量,则碳酸氢钠溶于水也是放出热量
D . 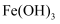 在空气中加热分解生成
在空气中加热分解生成 , 则
, 则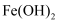 在空气中加热也分解生成
在空气中加热也分解生成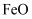
 的分子构型为直线形,则
的分子构型为直线形,则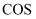 分子构型也为直线形
C . 碳酸钠溶于水放出热量,则碳酸氢钠溶于水也是放出热量
D .
分子构型也为直线形
C . 碳酸钠溶于水放出热量,则碳酸氢钠溶于水也是放出热量
D . 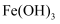 在空气中加热分解生成
在空气中加热分解生成 , 则
, 则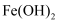 在空气中加热也分解生成
在空气中加热也分解生成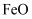
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 10gH218O和D2O的混合物所含的质子数为5NA
B . 含0.2molH2SO4的浓硫酸与足量铜共热,转移的电子数为0.2NA
C . 常温常压下,11.2L氧气中所含的氧原子数为NA
D . 0.1mol/LFeCl3滴入沸水中形成Fe(OH)3的胶粒数目为0.1NA
NA为阿伏加德罗常数的值,下列说法正确的是( )
A .  含有的化学键数为0.7NA
B .
含有的化学键数为0.7NA
B . 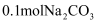 溶于水所得溶液中的阴离子数是0.2NA
C . 标准状况下,
溶于水所得溶液中的阴离子数是0.2NA
C . 标准状况下,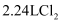 溶于足量水,转移的电子数为0.1NA
D .
溶于足量水,转移的电子数为0.1NA
D .  中含有的质子数、中子数和电子数均为0.1NA
中含有的质子数、中子数和电子数均为0.1NA
 含有的化学键数为0.7NA
B .
含有的化学键数为0.7NA
B . 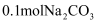 溶于水所得溶液中的阴离子数是0.2NA
C . 标准状况下,
溶于水所得溶液中的阴离子数是0.2NA
C . 标准状况下,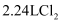 溶于足量水,转移的电子数为0.1NA
D .
溶于足量水,转移的电子数为0.1NA
D .  中含有的质子数、中子数和电子数均为0.1NA
中含有的质子数、中子数和电子数均为0.1NA
下列实验现象的描述错误的是( )
A . 钠投入水中,在水面上游动并熔化成小球,有气泡产生
B . 向碳酸钠固体中加入少量水后,碳酸钠溶解,并伴随有吸热现象
C . 铁丝在氯气中燃烧,产生棕红色的浓烟,溶于少量水后溶液呈棕黄色
D . 氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾
最近更新



