第一节 铁及其化合物 知识点题库
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | KSCN可用来检验Fe3+ | 用KSCN溶液检验FeSO4是否变质 |
B | 盐的水解是吸热反应 | 加热可提高盐的水解反应速率 |
C | H2O2有氧化性 | H2O2能使酸性KMnO4溶液褪色 |
D | Al(OH)3是两性氢氧化物 | Al(OH)3可溶于过量浓氨水中 |
A.加入铜粉B.加入铁粉 C.通入氯气D.加入KSCN溶液
根据选用的试剂,写出除去FeCl3溶液中少量的氯化亚铁过程中发生反应的离子方程式 .
(2)电子工业常用30%的FeCl3溶液腐蚀铜箔,制造印刷线路板,写出FeCl3与金属铜反应的离子方程式 .
(3)向沸水中逐滴滴加1mol•L﹣1FeCl3溶液至液体呈透明的红褐色,该分散系中微粒直径的范围是 ,区别该液体和FeCl3溶液可用 方法.
硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义.利用硫铁矿烧渣制备铁红等产品的实验流程如下:

已知几种盐的溶解度随温度变化的曲线如下图所示:
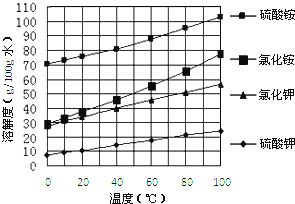
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是 .
(2)煅烧FeCO3生成产品I的化学反应方程式为 .实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有 .
(3)产品Ⅱ的化学式为 ,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: .
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液, .
-
(1) 取少量Fe2O3粉末(红棕色)加入适量盐酸,发生反应的化学方程式为,反应后得到的溶液呈色.用此溶液分别做如下实验:
取少量溶液置于试管中,滴入几滴NaOH溶液,可观察到有红褐色沉淀生成,反应的化学方程式为,此反应属于.
-
(2) 在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈色,即制得Fe(OH)3胶体.
-
(3) 取另一只小烧杯也加入20mL蒸馏水,向烧杯中加入1mL FeCl3溶液,振荡均匀后,将此烧杯(编号甲)与盛有Fe(OH)3胶体的烧杯(编号乙)一起放置于暗处,分别用激光笔照射烧杯中的液体,可以看到烧杯中的液体产生丁达尔效应.这个实验可以用来区别.
-
(4) 取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中滴加一定量的稀HI溶液,边滴加边振荡,会出现一系列变化.
①先出现红褐色沉淀,原因是.
②随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式:.
③最后溶液颜色加深,原因是.(用离子方程式表示).
④用稀盐酸代替稀HI溶液,能出现上述哪些相同的变化现象(写序号).
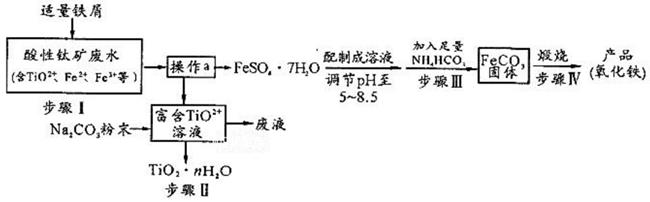
已知:TiO2+易水解,只能存在于强酸性溶液中。
-
(1) TiO2+钛的化合价为。
-
(2) 步骤Ⅰ中检验钛矿废水中加入铁屑是否足量的试剂是。
-
(3) 操作a是蒸发浓缩、冷却结晶、。
-
(4) 步骤Ⅲ中发生反应的化学方程式为;反应温度一般需控制在35℃以下,其目的是。
-
(5) 已知Ksp=[Fe(OH)2] = 8×10-16。步骤Ⅲ中,FeCO3达到溶解平衡时,若室温下测得溶液的pH为8.5, c(Fe2+) = 1×10-6mol/L。试判断所得的FeCO3中(填“有”或“没有”)Fe(OH)2;步骤Ⅳ中,为了得到较为纯净的Fe2O3 , 除了适当的温度外,还需要采取的措施是。
-
(6) 向“富含TiO2+溶液”中加入Na2CO3粉末易得到固体TiO2• nH2O。请结合原理和化学用语解释其原因。
-
(1) Fe(Al)试剂:;离子方程式:。
-
(2) FeCl3溶液(FeCl2)试剂:;离子方程式:。
 Fe(OH)3+3H+
C . 向该溶液中滴加几滴KSCN溶液无明显现象,再滴加少量氯水,溶液变红色
D . 向1 L 0.1 mol/L NH4Fe(SO4)2溶液中滴入过量的Ba(OH)2溶液,可生成0.2 mol沉淀
Fe(OH)3+3H+
C . 向该溶液中滴加几滴KSCN溶液无明显现象,再滴加少量氯水,溶液变红色
D . 向1 L 0.1 mol/L NH4Fe(SO4)2溶液中滴入过量的Ba(OH)2溶液,可生成0.2 mol沉淀

下列说法正确的是( )
 ,可能含有
,可能含有  C . 溶液丁中的阳离子一定只含H+、Fe2+
D . 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 , 可能含有NaHCO3、Na2CO3
C . 溶液丁中的阳离子一定只含H+、Fe2+
D . 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 , 可能含有NaHCO3、Na2CO3
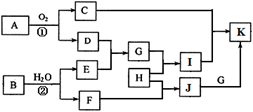
-
(1) 反应②的化学方程式为,该反应在化工生产中的目的是。
-
(2) 检验I中阳离子的实验操作为。
-
(3) 在化工生产中每燃烧0.12 kg A就会放出853 kJ热量,则A燃烧的热化学方程式为。
 氧化
氧化  时发现异常现象,并对其进行深入探究。
时发现异常现象,并对其进行深入探究。
-
(1) 实验I:
装置与操作
现象
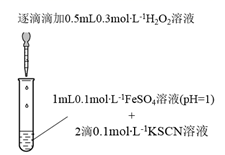
溶液立即变红,继续滴加
 溶液,红色变浅并逐渐褪去
溶液,红色变浅并逐渐褪去实验I中溶液变红是因为
 与
与 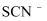 发生了反应,其离子方程式是。
发生了反应,其离子方程式是。 -
(2) 探究实验I中红色褪去的原因:取反应后溶液,(填实验操作和现象),证明溶液中有
 ,而几乎无
,而几乎无 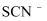 。
。
-
(3) 研究发现,酸性溶液中
 能氧化
能氧化 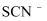 ,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测
,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测  能加快
能加快  与
与 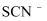 的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III: 。
的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III: 。 实验II:

实验III:
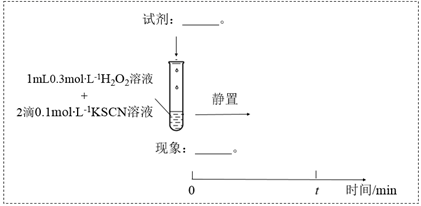
-
(4) 查阅资料:
 加快
加快  与
与 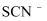 反应的主要机理有
反应的主要机理有 i.
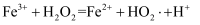
ii.

iii.
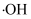 (羟基自由基)具有强氧化性,能直接氧化
(羟基自由基)具有强氧化性,能直接氧化 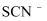
为探究
 对
对  与
与 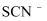 反应速率的影响,设计实验如下:
反应速率的影响,设计实验如下:实验IV:
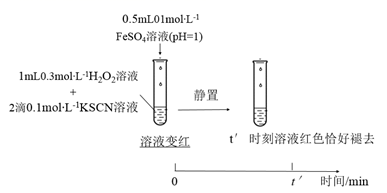
①t′<t,对比实验IV和II可得出结论:在本实验条件下,。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:。
③实验I~IV中均有
 生成,小组同学推测可能是
生成,小组同学推测可能是  与溶液中其他微粒相互作用生成的,这些微粒有。
与溶液中其他微粒相互作用生成的,这些微粒有。
| 选项 | X | Y | Z | W | |
| A | S | SO2 | H2SO3 | Na2SO4 | |
| B | Na | Na2O2 | Na2CO3 | NaCl | |
| C | Cl2 | Ca(ClO)2 | HClO | HCl | |
| D | Fe | Fe2(SO4)3 | FeSO4 | Fe(OH)2 |
| 选项 | 实验操作和现象 | 结论 |
| A | 向某溶液中,滴加氯水后,再滴加KSCN溶液,结果溶液变为红色 | 该溶液中一定含有Fe2+ |
| B | 向硫酸催化下的淀粉溶液中,加入新制Cu(OH)2悬浊液,并加热,结果未生成砖红色沉淀 | 该淀粉溶液一定未水解 |
| C | 向AgNO3溶液中加入NaCl溶液,生成白色沉淀,再滴加Na2S溶液,又生成黑色沉淀 | Ksp(AgCl)>Ksp(Ag2S) |
| D | 用醋酸浸泡有水垢的水壶,能除去水垢 | 酸性:CH3COOH>H2CO3 |

-
(1) 同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
-
(2) 同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为 。
-
(3) 同学乙打开a的目的 ;(填甲或乙)同学可成功。