第一节 铁及其化合物 知识点题库
①SiO2→Na2SiO3 ②Fe(OH)2→Fe(OH)3 ③SiO2→H2SiO3
④Al2O3→Al(OH)3 ⑤Na2O2→NaCl ⑥NaAlO2→AlCl3 .
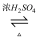 CH3COOC2H5+H
CH3COOC2H5+H  18O
B . 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+
C . 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D . 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
18O
B . 向某溶液中滴加KSCN溶液,溶液呈血红色,证明存在Fe3+而没有Fe2+
C . 常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D . 沉淀溶解达到平衡时,溶液中溶质的离子浓度不一定相等,但保持不变
-
(1) 金属铝是活泼的金属,但在生活中的应用仍很广泛,原因是.
-
(2) 在一个瘪了的铝制易拉罐加入适量的NaOH溶液,并密封,易拉罐会慢慢复原,原因是(用化学方程式表示).
-
(3) 写出还原铁粉与水蒸气反应的化学方程式.
-
(1) 过氧化钠与水反应的化学方程式:;
-
(2) 硫酸铝溶液与氨水反应的离子方程式:;
-
(3) 铁单质与水蒸气反应的化学方程式:;
-
(4) 二氧化硅与氢氟酸反应的化学方程式:。
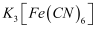 溶液是检验
溶液是检验 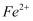 的试剂,若溶液中存在
的试剂,若溶液中存在 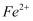 ,将产生蓝色沉淀。将
,将产生蓝色沉淀。将 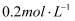 的KI溶液和
的KI溶液和 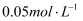
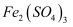 溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“
溶液等体积混合后,取混合液分别完成下列实验,能说明溶液中存在化学平衡“  ”的是( )
”的是( ) 实验编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入 | 有黄色沉淀生成 |
③ | 滴入 | 有蓝色沉淀生成 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中 ③K+、Fe3+、NO3-、SCN﹣在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料 ⑤将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
-
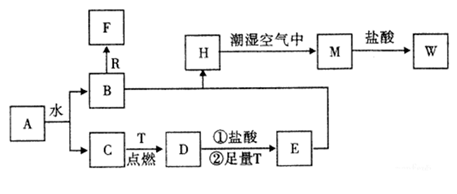
(1) 物质A的化学式为 ,F化学式为 ;
-
(2) B和R在溶液中反应生成F的离子方程式为;
-
(3) H在潮湿空气中变成M的实验现象是,化学方程式为;
-
(4) A和水反应生成B和C的化学方程式为,由此反应可知A有作为的用途;
-
(5) W溶液中滴加KSCN溶液出现血红色的离子方程式。
 和
和  的样品溶解在过量的
的样品溶解在过量的 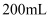 物质的量浓度为
物质的量浓度为 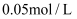 的
的  溶液中,然后向其中加入
溶液中,然后向其中加入  溶液使
溶液使  、
、  刚好完全沉淀,用去
刚好完全沉淀,用去  溶液
溶液 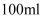 ,则
,则  溶液的浓度为( )
溶液的浓度为( )
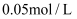 B .
B . 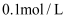 C .
C .  D .
D . 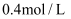
-
(1) I、硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO·B2O3·H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:

已知: H3BO3在20℃、40℃、60℃、100℃时溶解度依次为5.0g、8.7g、14.8g、40.2 g。
浸出渣除了CaSO4外,还有; (写化学式)
-
(2) “浸出液”显酸性,含H3BO3和Mg2+、SO
 , 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, 除去的杂质离子是; H2O2的作用是(用离子方程式表示)。
, 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, 除去的杂质离子是; H2O2的作用是(用离子方程式表示)。
-
(3) “浸取”后,采用“热过滤”的目的是
-
(4) 以硼酸为原料可制得硼氢化钠(NaBH4)它是有机合成中的重要还原剂,其电子式为
-
(5) II、为了分析矿石中铁元素的含量,先将浸出液处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式:5Fe2+ + MnO
 + 8H+= 5Fe3+ + Mn2+ + 4H2O
+ 8H+= 5Fe3+ + Mn2+ + 4H2O 滴定前是否要滴加指示剂?(填“是”或“否");
-
(6) 达到滴定终点的标志是
-
(7) 某同学称取4.000g样品,经处理后在容量瓶中配制成100mL溶液,移取25.00mL试样溶液,用1.000×10-2mol/L KMnO4标准溶液滴定。达到滴定终点时消耗标准溶液20.00 mL, 则样品中铁元素的质量分数是
| 选项 | 实验操作和现象 | 结论 |
| A | 向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S酸性比H2SO4强 |
| B | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热未出现砖红色沉淀 | X不可能是葡萄糖 |
| C | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 反应物浓度越大,反应速率越大 |
| D | 取5mL0.1mol·L-1KI溶液,加入1mL0.1mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
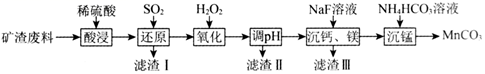
已知:i.当微粒浓度低于10-5mol·L1时,认为溶液中不存在该微粒;
ⅱ.常温下,部分难溶物的溶度积常数如下表:
| 难溶物 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| Ksp | 1×10-38 | 1×10-16 | 2×10-13 | 2×10-25 |
回答下列问题:
-
(1) “滤渣I”的成分为(填化学式,下同);流程最终回收的含铁化合物为。
-
(2) 通入SO2“还原”时需要不断搅拌,不断搅拌的目的为,该过程中发生的主要氧化还原反应的离子方程式为。
-
(3) “氧化”时需要少量、多次加入H2O2 , 其目的是。
-
(4) “调pH”时可选择的试剂为___________(填字母)。A . MnO2 B . Fe2O3 C . NH3·H2O D . FeO
-
(5) 常温下,若“调pH”后所得溶液中c(Mn2+)=0.2 mol·L-1、c(Mg2+)=0.002 mol·L-1 , 则所调pH的范围为。
-
(6) “沉锰”时发生反应的离子方程式为。
-
(1) 取少量黄色溶液,(填操作和现象),证明黄色溶液中含有Fe3+。
-
(2) 取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为。
-
(3) 探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为。
②用FeSO4和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
实验编号
Ⅰ
Ⅱ
Ⅲ
Ⅳ
c(FeSO4)/(mol·L−1)
0.5
0.25
0.5
0.25
溶液pH
3.3
3.5
2.9
2.9
初始颜色
浅绿色
浅绿色,比Ⅰ浅
浅绿色,同Ⅰ
浅绿色,同Ⅱ
0.5h颜色
浅绿色
黄绿色
浅绿色
浅绿色
5h颜色
黄色
黄色
浅黄色
浅黄色(比Ⅲ浅)
a.实验Ⅲ和Ⅳ说明对溶液变黄快慢有影响。
b.实验Ⅱ比Ⅰ更快变黄的原因是。
-
(4) 检验黄褐色沉淀的成分。
①通过下列实验证实,黄褐色沉淀中含有SO42-。
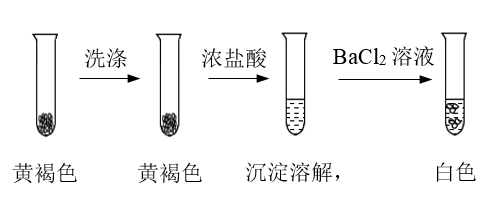
a.证实黄褐色沉淀中含有SO42-的证据是。
b.洗涤黄褐色沉淀的目的是。
②进一步实验证实黄褐色沉淀为Fe(OH)SO4.将反应的离子方程式补充完整:Fe3+++=Fe(OH)SO4↓+。
-
(5) 根据以上实验,配制FeSO4溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和稀硫酸,其中稀硫酸的作用是(答出两点)。
实验l:向FeSO4溶液中滴入少许Na2CO3溶液,出现白色沉淀。
实验2:向FeSO4溶液中加入NaOH溶液,出现白色絮状沉淀,渐变成灰绿色,最后成红褐色沉淀。
实验3:向FeSO4溶液中滴入KSCN溶液,出现红色。
实验4:向FeSO4溶液中滴入酸性KMnO4溶液,KMnO4溶液褪色。
下列说法错误的是( )
 =FeCO3↓
B . 实验2现象说明Fe(OH)2具有还原性
C . 实验3现象说明FeSO4氧化变质
D . 实验4现象说明FeSO4具有漂白性
=FeCO3↓
B . 实验2现象说明Fe(OH)2具有还原性
C . 实验3现象说明FeSO4氧化变质
D . 实验4现象说明FeSO4具有漂白性
 中燃烧制取
中燃烧制取 C . 过量的
C . 过量的 与稀硝酸反应生成
与稀硝酸反应生成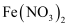 D . 铁在热的浓硝酸中钝化
D . 铁在热的浓硝酸中钝化
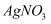 溶液
溶液


