实验活动3 同周期、同主族元素性质的递变 知识点题库
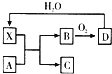
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )
(1)写出KO2与CO2的反应方程式 .
(2)1kgNa2O2和1kgKO2 , 分别和CO2反应,生成的O2体积比(同温同压下)为 .
(3)等物质的量的CO2分别与足量的Na2O2 , KO2反应生成的O2体积比(同温同压下)为 .
(4)你认为选用 作补氧剂更为合适,理由是 .
-
(1)
与氧气反应差异性:(将横线补充完整)
Li+O2
 ( 色、氧化锂);
( 色、氧化锂);Na+O2
 ( 色、过氧化钠);
( 色、过氧化钠);K+O2
 ( 色,);
( 色,);Rb+ O2
 (棕色、);
(棕色、);CS+ O2
 ( 色、 ).
( 色、 ). -
(2) 与水反应差异性:(填反应现象)
2Li+2H2O=2LiOH+H2↑( );
2Na+2H2O=2NaOH+H2↑(剧烈);
2K+2H2O=2KOH+H2↑( );
2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸).
-
(3) 写出下列反应的化学方程式:
过氧化钾与CO2: ;
超氧化钾与水、CO2: 、 ;
氧化锂与水、CO2: 、 .
-
(1) 基态Br原子的核外电子排布式为,其价电子层成对与未成对电子个数比为
-
(2) 下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是

-
(3) BCl3中心原子的杂化方式为,NCl3分子的空间构型为;第一电离能介于B、N之间的第二周期元素有(填元素符号).
-
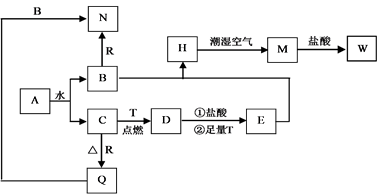
(1) 写出下列物质的化学式
ADR
-
(2) 按要求写下列反应方程式
H在潮湿空气中变成M的化学方程式
D与盐酸反应的离子方程式
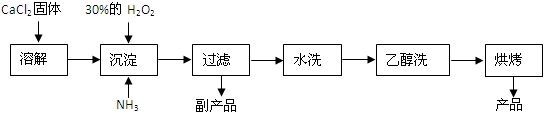
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
-
(1) 用上述方法制取CaO2·8H2O的化学方程式是。
-
(2) 检验“水洗”操作滤液中是否含Cl- , 的正确操作是。
-
(3) 沉淀时常用冰水控制温度在0℃左右有利于提高CaO2·8H2O产率,其可能原因是(写出两种)①;②。
-
(4) 测定产品中CaO2含量的实验步骤:
第一步:准确称取ag产品于有塞锥形瓶中,加入适量蒸馏水和过量的bgKI晶体,
再滴入少量2mol·L-1的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为cmol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液
VmL。(已知:I2+2S2O32-=2I-+S4O62-)
①CaO2的质量分数为(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不变”、“偏低”或“偏高”),原因是。
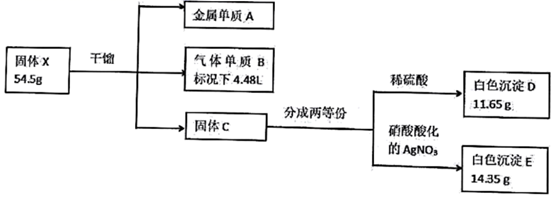
已知X是由三种元素组成的盐,金属单质A银白色常用于实验室做焰色反应实验,不溶于硝酸;气体B在标准状况下的密度为3.17 g/L;所加试剂均足量。
-
(1) X的化学式,固体C的电子式。
-
(2) 金属A溶于王水(浓硝酸:浓盐酸=1:3)生成化合物X对应的酸和遇空气显红棕色的气体,写出金属A溶于王水的化学方程式。
-
(3) 与B中元素同主族元素之间形成的化合物的性质与气体单质B相似,在碱性环境中,XO-→X-+XO
 ,非金属性越弱该反应越容易发生。写出该族第四周期与第五周期元素形成的化合物YZ与氢氧化钠溶液反应的离子方程式。
,非金属性越弱该反应越容易发生。写出该族第四周期与第五周期元素形成的化合物YZ与氢氧化钠溶液反应的离子方程式。
-
(4) 下列有关说法正确的是___________。A . 用金属A做焰色反应实验时,需用稀硫酸洗净 B . 某试剂做焰色反应实验时,火焰黄色,证明一定有钠盐,但不一定有钾盐。 C . 工业上使用阴离子交换膜电解饱和食盐水生产气体B D . 白色固体D可用于医疗上检查肠胃的内服药剂 E . 白色沉淀E在光照下颜色会变深,可能溶于氨水



