实验活动3 同周期、同主族元素性质的递变 知识点题库
①金属钠投入到烧杯中的FeCl2溶液中 ②过量NaOH溶液和明矾溶液混合
③少量Ca(OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中滴入少量NaHSO4溶液
⑤向饱和Na2CO3溶液中通入足量CO2
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
Ⅰ(1)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢; 与盐酸反应产生的气体最多.
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
Ⅱ.利用图装置可验证同主族元素非金属性的变化规律
(3)仪器B的名称为 ,干燥管D的作用为防止
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4 , (KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液 的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用 溶液吸收尾气.
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液 的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有 溶液的洗气瓶.

过氧化钠是一种淡黄色固体,它能与二氧化碳反应生成氧气,在潜水艇中用作制氧剂,供人类呼吸之用.它与二氧化碳反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2 . 某学生为了验证这一实验,以足量的大理石、足量的盐酸和1.95g过氧化钠样品为原料,制取O2 , 设计出如下实验装置:

(1)A中制取CO2的装置,应从下列图①、②、③中选哪个图:

B装置的作用是 ,C装置内可能出现的现象是 .为了检验E中收集到的气体,在取出集气瓶后,方法是 .
(2)若E中的石灰水出现出现轻微白色浑浊,请说明原因: .
(3)若D中的1.95g过氧化钠样品接近反应完毕时,你预测E装置内有何现象? .
(4)反应完毕时,若测得E中的集气瓶收集到的气体为250mL,又知氧气的密度为1.43g/L,当装置的气密性良好的情况下,实际收集到的氧气体积比理论计算值 (答大或小),相差约 mL(取整数值,所用数据均在标准状况下测定),这是由于 .
-
(1) 写出Na2O2与水反应的化学方程式.
-
(2) 试设计实验证明溶液X中含过氧化氢.
-
(3) 通过上述实验证明溶液中确实存在H2O2 . 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2+Fe2++OH﹣﹣﹣ Fe(OH)3↓,该反应中H2O2表现了性(填“氧化”或“还原”).
-
(4) 已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了性(填“氧化”或“还原”).
-
(1) 观察钾的切面.硬度:,颜色:,状态.
-
(2) 预测钾的性质,写出下列反应的化学方程式:
①在空气中缓慢氧化:;
②点燃剧烈燃烧:;
③与水剧烈反应:.
①都是银白色的柔软金属(除铯外),密度都比较小
②单质在空气中燃烧生成的都是过氧化物
③碱金属单质都与水剧烈反应
④单质的熔、沸点随着原子序数的增加而升高
【査阅资料】①Mg在氮气中燃烧生成氮化镁(Mg3N2),氮化镁与水发生复分解反应,有NH3生成。
②CaO2遇水反应生成H2O2 , H2O2会分解产生一定量的O3。
③碘量法是最常用的臭氧测定方法,其原理为:O3+2KI+H2O=O2+I2+2K0H
-
(1) 甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性,因此可以推断Ca在空气燃烧时,能与空气中的氮气反应生成。
-
(2) 乙同学提出:Ca的性质比Na活泼,在空气中燃烧也有CaO2生成,其化学方程式为:。
-
(3) 丙同学对臭味气体的成分提出三种假设。
【提出假设】假设1:产生臭味的气体只是O3;
假设2:产生臭味的气体只是;
假设3:产生臭味的气体是。
-
(4) 【实验探究】为此,同学们对臭味气体的成分进行了实验探究。实验室提供的实验试剂有:红色石蕊试纸、蓝色石蕊试纸、淀粉-KI试纸、蒸馏水。
请按下列表格填写完成实验操作、与结论相应的预期现象:
实验操作
预期现象
结论
取少量钙在空气中充分燃烧后的 固体产物于试管中,加少量蒸熘水,分别用、在短时间内快速检测产生的气体。
假设1成立
假设2成立
假设3成立
 已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀
已知:AgBr、AgI分别为浅黄色和黄色不溶于硝酸的沉淀  ,则下列叙述正确的是( )
,则下列叙述正确的是( )

提示:①MgCl2晶体的化学式为MgCl2·6H2O。
②MgO的熔点为2852℃,无水MgCl2的熔点为714℃。
-
(1) 操作①的名称是,操作②的名称、、过滤。
-
(2) 试剂a的名称是。
-
(3) 用氯化镁电解生产金属镁的化学方程式为。
已知:①2LiH⇌2Li+H2 △H>0
②LiH+H2O=LiOH+H2↑
下列说法错误的是( )
 B . 沸点高低:
B . 沸点高低:  C . 金属性强弱:
C . 金属性强弱:  D . 原子半径大小:
D . 原子半径大小: 
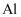 与氢氧化钠溶液反应,故
与氢氧化钠溶液反应,故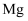 也可以
B . 金刚石的硬度大,则
也可以
B . 金刚石的硬度大,则 的硬度也大
C .
的硬度也大
C . 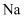 常温下与水剧烈反应,故K常温下也能与水剧烈反应
D .
常温下与水剧烈反应,故K常温下也能与水剧烈反应
D .  与
与 化学式相似,则
化学式相似,则 与
与 的物理性质也相似
的物理性质也相似



