第一节 化学反应与能量变化 知识点题库
 2Fe(s)+3CO2(g)△H=a kJ•mol﹣1 .
2Fe(s)+3CO2(g)△H=a kJ•mol﹣1 .
-
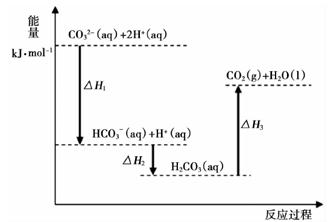
(1) 已知:①Fe2O3(s)+3C(s,石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol﹣1;
②C(s,石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol﹣1 . 则a=.
-
(2) 冶炼铁反应的平衡常数表达式K=,温度升高后,K值(填“增大”、“不变”或“减小”).
-
(3) 在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
Fe2O3
CO
Fe
CO2
甲/mol
1.0
1.0
1.0
1.0
乙/mol
1.0
2.0
1.0
1.0
①甲容器中CO的平衡转化率为.
②下列说法正确的是(填字母).
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.增加Fe2O3的量,可以提高CO的转化率
c.甲容器中CO的平衡转化率大于乙的平衡转化率
d.甲、乙容器中,CO的平衡浓度之比为2:3
-
(4) 采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a、b、c装置中能保护铁的是(填字母).
②若用d装置保护铁,X极的电极材料应是(填名称).

-
(5) 25℃时有关物质的溶度积如下:Ksp[Mg(OH)2]=5.61×10﹣12 , Ksp[Fe(OH)3]=2.64×10﹣39.25℃时,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=.

 O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
O2(g)=H2O(l) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )


下列说法正确的是( )

-
(1) 若已知H—H键的键能为436.0kJ·mol-1 , N—H的键能为390.8kJ·mol-1 , 则N≡N的键能约为kJ·mol-1。
-
(2) 合成氨反应不加催化剂很难发生,催化剂铁触媒加入后参与了反应降低了活化能。其能量原理如图所示,则加了催化剂后整个反应的速率由决定(填“第一步反应”或者“第二步反应”),未使用催化剂时逆反应活化能正反应活化能(填“大于”“小于”或者“等于”)。

-
(3) 一定温度下恒容容器中,以不同的H2和N2物质的量之比加入,平衡时NH3体积分数如图所示,则H2转化率a点b点(填“大于”“小于”或者“等于”)。若起始压强为20MPa,则b点时体系的总压强约为MPa(保留两位有效数字)。

-
(4) 常温下,向20mL的0.1mol·L-1的盐酸中通入一定量氨气反应后溶液呈中性(假设溶液体积变化忽略不计)则所得溶液中c(
 )=。
)=。
 B . 白磷转变为红磷是放热反应
B . 白磷转变为红磷是放热反应  C . S(g)+O2(g)=SO2(g)△H1 , S(s)+O2(g)=SO2(g)△H2 , 则△H1>△H2
C . S(g)+O2(g)=SO2(g)△H1 , S(s)+O2(g)=SO2(g)△H2 , 则△H1>△H2  D . CO(g)+H2O(g)=CO2(g)+H2(g)△H<0
D . CO(g)+H2O(g)=CO2(g)+H2(g)△H<0 
 CO2(g) +H2(g),反应过程中测定的部分数据见下表(表中t1>t2)
CO2(g) +H2(g),反应过程中测定的部分数据见下表(表中t1>t2) | 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
下列说法正确的是( )
 mol·L-1·min-1
B . 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20 mol H2O,到达平衡时,n(CO2)=0.40 mol
C . 保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D . 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
mol·L-1·min-1
B . 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20 mol H2O,到达平衡时,n(CO2)=0.40 mol
C . 保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D . 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
|
共价键 |
H-H 键 |
N三N键 |
N-H 键 |
|
键能(kJ/mo1) |
436 |
945 |
391 |
工业合成氨的化学方程式: N2+3H2  2NH3
2NH3
-
(1) 断开1mol N2中的化学键需(填“吸收”或“放出”) kJ 能量;
-
(2) 形成2mol NH3中的化学键需(填“吸收”或“放出”)kJ 能量;
-
(3) 在298 K时,取1mol N2和3 mol H2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1 , 则Q1为kJ。根据上表中的数据判断工业合成氨的反应是(填“吸热”或“放热”)反应。


-
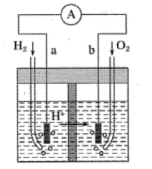
(1) 若a电极材料为碳、b溶液为FeCl3溶液,则正极的电极反应式为,当有3.2g的负极材料溶解时,导线中转移的电子的数目为。
-
(2) 氢氧燃料电池已用于航天飞机。这种电池以30%KOH溶液为电解质溶液,供电时总反应为2H2+O2=2H2O,则正极的电极反应式为,该燃料电池的优点是。
-
(3) 已知H—H键、N—H键、N≡N键的键能分别为436kJ·mol-1、391kJ·mol-1、946kJ·mol-1 , 关于工业合成氨的反应,请根据键能的数据判断下列问题:
若有1molNH3生成,可(填“吸收”或“放出”)热量kJ;该反应的能量变化可用图(填“甲“或“乙”)表示。

 已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
已知:①氧化性:Cu2+>H+(酸)>Ni2+>Fe2+>H+(水);
②常温下溶度积常数:  、
、  。
。
-
(1) 步骤①所得炉气和炉渣均能使酸性高锰酸钾溶液褪色,其中炉渣能使酸性高锰酸钾溶液褪色的原因是;炉气使酸性高锰酸钾溶液褪色的离子方程式为。
-
(2) 步骤③经相应溶剂萃取后得到NiSO4溶液的操作;在实验室中进行所需要使用的玻璃仪器有。
-
(3) 步骤⑥以NiS(含CuS)作阳极、NiSO4溶液作电解液电解可在极(填“阳”或“阴”)获得粗镍,阳极的主要电极反应式为。粗镍的电解精炼需要将电解液的pH控制在2~5之间,下列有关说法错误的是(填序号)。
A.防止溶液的酸性过强造成
 放电,在阴极生成H2
放电,在阴极生成H2B.防止溶液的酸性过弱使Ni2+转化成Ni(OH)2沉淀
C.若溶液的pH<2,可加入NiO或Ni(OH)2固体调节溶液的pH
D.使粗镍中所含的杂质Cu在阳极放电而进入电解液中
-
(4) 化学上常认为残留在溶液中的离子浓度小于
 时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+ , 若该溶液中的
时该离子沉淀完全。步骤③所得的NiSO4溶液中通常含有Cu2+ , 若该溶液中的  ,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:。
,请通过计算说明可通过在溶液中加入NiS的方法除去溶液中Cu2+的原因:。
 离子选泽双隔膜电池如图所示(KOH溶液中,
离子选泽双隔膜电池如图所示(KOH溶液中, 以
以 存在).电池放电时,下列叙述错误的是( )
存在).电池放电时,下列叙述错误的是( )

 通过隔膜向Ⅲ区迁移
B . Ⅰ区的
通过隔膜向Ⅲ区迁移
B . Ⅰ区的 通过隔膜向Ⅱ区迁移
C .
通过隔膜向Ⅱ区迁移
C .  电极反应:
电极反应: D . 电池总反应:
D . 电池总反应:
 O2(g)
O2(g) H2O(l) ΔH=285.8kJ·mol-1
D . “冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量高
H2O(l) ΔH=285.8kJ·mol-1
D . “冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量高
 Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),将一定量反应物置于体积为2 L的密闭容器中,测得平衡时氢气的体积分数随温度的变化如下图所示。
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s),将一定量反应物置于体积为2 L的密闭容器中,测得平衡时氢气的体积分数随温度的变化如下图所示。
完成下列填空:
-
(1) 该反应的正反应为反应(选填“吸热”或“放热”)。某温度下,进行上述反应至5 min时,混合气体质量增加1.2 g,则该时间段内的平均反应速率v(H2O) =。
-
(2) 若开始反应时,扩大容器体积,则图中H2的变化曲线将。(选填“上移”或“下移”)
-
(3) 1300 K时,图中M点H2O(g)的体积分数为;若此时往体系中再加入4 mol H2(g)和4 mol H2O(g),则平衡移动(选填“正向”、“逆向”或“不”),理由是。
-
(4) 硫化钠俗称臭碱,浓溶液有臭鸡蛋气味。Na2S溶液中c(OH-)-c(H+)c(HS-)+c(H2S) 。(选填“<”、“>”或“=”),往Na2S溶液中通入空气,产生淡黄色浑浊且溶液pH升高,解释其原因。

-
(1) 图甲为探究钢铁的吸氧腐蚀的装置。某兴趣小组按该装置进行实验,发现导管中水柱上升缓慢,下列措施可以更快、更清晰地观察到水柱上升现象的有____(填序号)。A . 用纯氧气代替具支试管内空气 B . 用酒精灯加热具支试管提高温度 C . 将铁钉换成铁粉和碳粉混合粉末并加入少许食盐水 D . 将玻璃导管换成更细的导管,水中滴加红墨水
-
(2) 该小组将图甲装置改进成图乙装置并进行实验,导管中红墨水液柱高度随时间的变化如表所示,根据数据可判断腐蚀的速率随时间变化逐渐(填“加快”“减慢”或“不变”),你认为影响钢铁腐蚀的因素为。
时间/min
1
3
5
7
9
液柱高度/cm
0.8
2.1
3.0
3.7
4.2
-
(3) 为探究图乙中a、b两点所发生的反应,进行以下实验,请完成表中空白:
实验操作
实验现象
实验结论
向NaCl溶液中滴加2~3滴酚酞溶液
a点附近溶液出现红色
a点电极反应为
一段时间后再滴加2~3滴铁氰化钾溶液
b点周围出现蓝色沉淀
b点电极反应为Fe-2e-=Fe2+
-
(4) 设计图丙装置研究弱酸性环境中腐蚀的主要形式。测定锥形瓶内气压和空气中氧气的体积分数随时间变化如图丁所示,从图丁中可分析,t1~t2s之间主要发生(填“吸氧”或“析氢”)腐蚀,原因是。


-
(5) 金属阳极钝化是一种电化学防护方法。将Fe作阳极置于H2SO4溶液中,一定条件下,Fe钝化形成致密Fe3O4氧化膜,试写出该阳极的电极反应。



