专题1 物质的分类及计量 知识点题库
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水.工业上制备K2FeO4的常用方法之一是次氯酸盐氧化法:①2FeCl3+10NaOH+3NaClO = 2Na2FeO4+9NaCl+5H2O,② Na2FeO4 + 2KOH = K2FeO4 + 2NaOH .下列说法错误的是( )
A . 反应①为氧化还原反应,反应②为复分解反应
B . 反应①中NaClO 是氧化剂
C . 反应②的产物K2FeO4中Fe为+4价,具有强氧化性,能杀菌消毒
D . 若有2 mol FeCl3 发生反应,转移电子的物质的量为 6 mol
已知NaNO2是色泽和味道与NaCl相似的盐,是导致某些建筑工地食物中毒的主要物质,它可与酸性KMnO4溶液发生反应2MnO  +5NO
+5NO  +a=b+5
+a=b+5  +3H2O。下列叙述正确的是( )
+3H2O。下列叙述正确的是( )
 +5NO
+5NO  +a=b+5
+a=b+5  +3H2O。下列叙述正确的是( )
+3H2O。下列叙述正确的是( )
A . a是6H+ , b是2MnO2
B . 反应过程中溶液的pH减小
C . 还原产物是Mn2+
D . 当有0.1 mol b生成时转移电子数为NA
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A . 物质的量浓度为0.5mol·L-1的MgCl2溶液中,含有Cl-数为NA
B . 标准状况下,22.4LH2O中含有的分子数为NA
C . 常温常压下,4g氦气中含氦原子数为NA
D . 过氧化钠与水反应时,生成1mol氧气转移的电子数为4NA
下列关于氯化铁溶液和氢氧化铁胶体的说法中,正确的是( )
A . 分散质的粒子直径均在1~100nm之间
B . 两者都具有丁达尔效应
C . 后者可用于净水
D . 前者是混合物,后者是纯净物
-
(1) 6.02×1023个氢氧根离子的物质的量是mol,其摩尔质量为。
-
(2) 在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为g·L−1(保留小数点后两位),该气体的相对分子质量为。
-
(3) 在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是,CO的体积分数是,CO的质量分数是,C和O原子个数比是,混合气体的平均相对分子质量是,密度是g·L−1。
根据物质的量的相关公式计算:
-
(1) 16gO3和16g O2分子数之比为,含氧原子数之比为;
-
(2) 12.7g FeCl2固体溶于水配成500mL溶液,其浓度为mol×L-1 , 从该溶液中取出100mL溶液,其中Cl-的浓度为mol×L-1;
-
(3) 某金属氯化物MCl227g,含有0.40 mol Cl- , 则该氯化物的物质的量为,M的摩尔质量为。
-
(4) 下列数量的各物质所含原子数按由大到小的顺序排列的是。
①34g氨气 ②标准状况下44.8L氦气 ③25℃时18 mL水 ④0.5 mol H2SO4
下列物质在水溶液中的电离方程式错误的是( )
A . NaHCO3=Na++H+ +CO32-
B . NaHSO4=Na+ +H+ +SO42-
C . MgCl2=Mg2++2Cl-
D . Ba(OH)2=Ba2+ +2OH-
电解质是指 ( )
A . 导电性很强的物质
B . 在溶于水或熔融状态下能导电的化合物
C . 在溶于水或熔融状态下能全部电离的化合物
D . 在溶于水或熔融状态下能导电的物质
世界卫生组织(WHO)将ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。ClO2属于( )
A . 酸
B . 碱
C . 氧化物
D . 盐
锰广泛存在于自然界中,工业可用软锰矿(主要成分是MnO2)制备锰。
资料:①MnCO3难溶于水,可溶于稀酸。
②在Mn2+催化下,SO2在水溶液中被氧化成H2SO4。
-
(1) I.制备
写出铝热法还原MnO2制备锰的化学方程式。
-
(2) 工业上制备锰时,会产生大量废水和锰渣。锰渣煅烧会产生含高浓度SO2的烟气,可用以下方法处理。
处理方法一:
①用软锰矿进行脱硫可生成硫酸锰,从而达到资源的循环使用。写出一定条件下利用MnO2进行脱硫的化学方程式。
②研究表明,用Fe2+/Fe3+可强化脱硫效果,其过程如下所示:

过程I:……
过程II :2Fe3++SO2+2H2O=2Fe2++
 +4H+
+4H+过程I的离子方程式是。
处理方法二:
③用MnCO3进行脱硫,可提高脱硫率。结合化学用语解释原因:。
-
(3) II.废水中锰含量的测定
取1 mL废水置于20 mL磷酸介质中,加入HClO4 ,将溶液中的Mn2+氧化为Mn3+ , 用c mol/L (NH4)2 Fe(SO4)2溶液进行滴定,达到滴定终点时,滴定管刻度由V0mL变为V1 mL,废水中锰的含量为 g/mL。
臭氧已成为夏季空气污染的元凶,地表产生臭氧的机理如图所示,NA代表阿伏加德罗常数的数值。下列说法正确的是( )
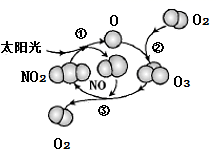
A . 反应①、②、③都是氧化还原反应
B . 16 O3和O2的混合气体,所含质子数为16NA
C . 0.5mol NO2溶于水形成1L溶液,可得到0.5 mol∙L−1的硝酸溶液
D . 标准状况下,11.2L的NO和O2混合气体所含的原子数为NA
下列关于胶体的叙述中,错误的是( )
A . Fe(OH)3胶体能吸附水中的悬浮颗粒并沉降,因此常用其对自来水的消毒
B . 浊液、胶体、溶液的本质区别是分散质粒子的直径大小
C . 可以用丁达尔效应区分FeCl3溶液和Fe(OH)3胶体
D . 胶态磁流体治癌是将磁性物质制成胶体粒子,这种粒子直径在10-9~10-7 m之间
若将mgNaOH固体溶于水恰好配成200mL饱和溶液,其密度为ρ g·cm-3 , 则下列说法正确的是( )
A . 溶质的质量分数为  B . 溶质的物质的量浓度为
B . 溶质的物质的量浓度为 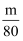 mol·L-1
C . 溶质和溶剂的物质的量之比为
mol·L-1
C . 溶质和溶剂的物质的量之比为  :
:  D . 从该溶液中取出50 mL,含NaOH的物质的量为
D . 从该溶液中取出50 mL,含NaOH的物质的量为  mol
mol
 B . 溶质的物质的量浓度为
B . 溶质的物质的量浓度为 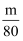 mol·L-1
C . 溶质和溶剂的物质的量之比为
mol·L-1
C . 溶质和溶剂的物质的量之比为  :
:  D . 从该溶液中取出50 mL,含NaOH的物质的量为
D . 从该溶液中取出50 mL,含NaOH的物质的量为  mol
mol
下列应用与胶体的性质没有关系的是( )
A . 放电影时,放映机到银幕间的光柱的形成
B . 早晨在树叶间看到的光路
C . 向FeCl3溶液中加入NaOH溶液,生成红褐色沉淀
D . 一束光线照射淀粉溶液,可看到光亮的通路
食盐中的碘以碘酸钾(KIO3)形式存在,可根据反应:  +5I-+6H+=3I2+3H2O验证食盐中存在
+5I-+6H+=3I2+3H2O验证食盐中存在  。根据上述反应,下列说法错误的是( )
。根据上述反应,下列说法错误的是( )
 +5I-+6H+=3I2+3H2O验证食盐中存在
+5I-+6H+=3I2+3H2O验证食盐中存在  。根据上述反应,下列说法错误的是( )
。根据上述反应,下列说法错误的是( )
A .  作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该条件下氧化性:
作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该条件下氧化性:  >I2
D . 被氧化的I原子和被还原的I原子个数比1:5
>I2
D . 被氧化的I原子和被还原的I原子个数比1:5
 作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该条件下氧化性:
作氧化剂,发生还原反应
B . I2既是氧化产物又是还原产物
C . 该条件下氧化性:  >I2
D . 被氧化的I原子和被还原的I原子个数比1:5
>I2
D . 被氧化的I原子和被还原的I原子个数比1:5
加入还原剂才能实现的过程是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2 , 下列说法正确的是( )
A . 若生成2.24 L HF,则转移0.4 mol电子
B . HF是氧化产物
C . O2F2既是氧化剂又是还原剂
D . 还原剂与氧化剂的物质的量之比为1:4
现有部分被氧化的Fe、Cu混合物(氧化物为Fe2O3、CuO)样品共5.60 g,经如下处理:

下列说法正确的是( )
A . V= 672
B . 滤液A中的阳离子为Fe2+、Fe3+、H+
C . 样品中氧元素的物质的量为0. 02 mol
D . 溶解样品的过程中消耗硫酸的总物质的量为0.05 mol
酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2 , 则下列说法正确的是( )
A . H3PO2属于一元酸
B . H3PO2属于三元酸
C . NaH2PO2属于酸式盐
D . NaH2PO2属于正盐
某次实验中预计需要使用480mL0.1mol·L-1的纯碱溶液,如图是某同学在实验室配制该溶液的流程图,回答下列问题:

-
(1) 此配制过程中,溶解纯碱首次向烧杯中加入蒸馏水的体积约为mL。
-
(2) 使用托盘天平的第一步操作是,需要称量纯碱的质量为。
-
(3) 本次配制应选择的最主要仪器为(只写1个)。
-
(4) 指出所给流程图中的操作有两个明显的不正确,请简要描述出不正确点:、。
-
(5) 指出操作对所配制溶液浓度的影响(填写“偏大”“偏小”或“无影响”)。
①溶解、转移溶液后,没有洗涤玻璃棒及烧杯:。
②定容时仰视刻度线:。
③容量瓶未干燥,有少量蒸馏水:。
最近更新



