专题1 物质的分类及计量 知识点题库
下列属于复盐的是( )
A . NaHCO3
B . CaCl(ClO)
C . (NH4)2Fe(SO4)2
D . Na2SO4·10H2O
在三个密闭容器中分别充入A、B、C三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的顺序为p(B)>p(A)>p(C),则A、B、C分别是( )
A . Ne、H2、O2
B . O2、N2、H2
C . NO、CO2、H2
D . NH3、O2、NO2
下列图示与对应的叙述相符的是( )

A . 图Ⅰ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B . 图Ⅱ表示常温下,0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1CH3COOH溶液所得到的滴定曲线
C . 图Ⅲ表示一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化曲线,图中a、b、c三点醋酸的电离程度:a<b<c
D . 图Ⅳ表示犮应4CO(g)+2NO2(g)  N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物 CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物 CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
 N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物 CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
N2(g)+4CO2(g) △H<0,在其他条件不变的情况下改变起始物 CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率b>a>c
某种半水煤气中主要含  、CO、
、CO、  、
、  和少量
和少量  ,经“脱硫”、转换反应可制得合成氨原料气。
,经“脱硫”、转换反应可制得合成氨原料气。
 、CO、
、CO、  、
、  和少量
和少量  ,经“脱硫”、转换反应可制得合成氨原料气。
,经“脱硫”、转换反应可制得合成氨原料气。
-
(1) 这种半水煤气跟空气按一定比例混合后通入
 、
、 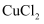 的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为
的混合溶液中完成“脱硫”,其转化过程如图所示,该过程中发生多个反应,总反应为  ,该转化过程中起催化作用的离子为,写出该过程中属于非氧化还原反应的离子方程式。
,该转化过程中起催化作用的离子为,写出该过程中属于非氧化还原反应的离子方程式。 
-
(2) 脱硫后的半水煤气与水蒸气以1:15比例混合后通入转换塔中,变换反应为:
 。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成:
。该反应用氧化铁作催化剂,其活性组分是四氧化三铁。研究发现,变换反应经下列两步完成: 第一步:

 (慢反应)
(慢反应)第二步:

 (快反应)
(快反应)①在下图中绘制变换反应(经上述催化反应过程)的“能量~反应过程”示意图。

②由于
 和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是。
和CO还原性较强,能够将氧化铁直接还原成铁而使催化剂失活,但实际生产中一般不会发生这种情况,请从反应速率,化学平衡角度解释可能的反应过程原因是。 -
(3) 半水煤气处理后得到的混合气中,可通过在熔融碳酸盐中经电化学还原消除其中的二氧化碳,并得到高纯度的碳,写出生成碳的电极反应式为。
现有下列物质:①稀硫酸 ②小苏打 ③氨水 ④二氧化碳 ⑤FeCl3固体 ⑥稀NaOH溶液 ⑦硝酸亚铁溶液。
-
(1) 上述物质中属于电解质的物质序号为 。
-
(2) 有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是。
-
(3) 加入盐酸、NaOH溶液均能发生化学反应的物质序号为。
-
(4) 能导电的物质序号为。
-
(5) ④与⑥充分反应后,将溶液小火蒸干,得到固体混合物。固体组成成分可能是(用化学式表示)。
-
(6) 实验室用⑤制备胶体的化学方程式为。如果将1molFeCl3全部制成胶体,制得的胶体(选填“带负电”“电中性”“带正电”),胶粒数目NA(选填“大于”“等于”“小于”)。
四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具  水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法错误的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法错误的是 

 水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法错误的是
水热法制备Fe3O4纳米颗粒的反应是:3Fe2+ + 2S2O32-+ O2 + xOH- = Fe3O4↓+ S4O62- + 2H2O 。下列说法错误的是 

A . 参加反应的氧化剂与还原剂的物质的量之比为1:5
B . 若有2molFe2+ 被氧化,则被Fe2+还原的O2的物质的量为0.5mol
C . 每生成1molFe3O4 , 反应转移的电子为4mol
D . O2是氧化剂,S2O32-与Fe2+是还原剂
下列物质分类正确的是( )
| 选项 | 酸 | 碱 | 盐 | 酸性氧化物 |
| A | NaHSO4 | NaOH | CaCO3 | NO2 |
| B | H2SO4 | Na2CO3 | NH4Cl | SO2 |
| C | CH3COOH | Ba(OH)2 | CaCl2 | CO |
| D | HNO3 | KOH | NaHCO3 | SO3 |
A . A
B . B
C . C
D . D
下列转化中,需要加入还原剂才能实现的是( )
A . Na → NaOH
B . HCO  → CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
→ CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
 → CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
→ CO2
C . Fe3+ → Fe2+
D . Cl- → Cl2
请回答下列问题:
-
(1) 现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH ⑧盐酸。其中能导电的是,(填序号,下同),属于电解质的是,属于非电解质的是。
-
(2) 下列所给出的几组物质中:含有分子数最少的是;含有原子数最多的是;标准状况下体积最小的是。
①1 g H2 ②2.408×1023个CH4分子 ③10.8 g H2O ④标准状况下6.72 L CO2。
-
(3) 实验室欲用固体NaOH来配制90ml 0.5 mol/L的NaOH溶液,需要称量固体NaOHg。配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。其正确的操作顺序为。在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是(填字母)。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中定容
C.容量瓶不干燥,含有少量蒸馏水
D.称量时间过长
已知NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 常温下2.2gCO2中含有共用电子对的数目为2NA
B . 标准状况下,11.2L乙醇中含的碳原子数为NA
C . 25℃时,0.1mol/L的一元强酸HA中,H+的个数为0.1NA
D . 6.4gCu与一定浓度的HNO3完全反应得到混合气体,则反应转移的电子数为0.2NA
设NA为阿伏加德罗常数的值,则下列叙述正确的是( )
A . 28gCO和N2混合气体中含有的原子总数为2NA
B . 标准状况下,22.4LSO3所含的分子数为NA
C . 足量铜与1L18mol/L浓硫酸反应可以得到SO2的分子总数为9NA
D . 等体积的NO和NO2中所含氮原子数目相同
下列有关分散系的叙述,错误的是( )
A . 胶体区别于其它分散系的本质特征是胶体粒子的直径大小在  之间
B . 区别
之间
B . 区别 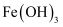 胶体和
胶体和  溶液可利用胶体具有丁达尔效应
C . 向
溶液可利用胶体具有丁达尔效应
C . 向  溶液中滴加饱和的
溶液中滴加饱和的  溶液可制得
溶液可制得 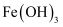 胶体
D . 溶液、液溶胶的分散质的粒子能透过滤纸,悬浊液的分散质的粒子不能透过滤纸
胶体
D . 溶液、液溶胶的分散质的粒子能透过滤纸,悬浊液的分散质的粒子不能透过滤纸
 之间
B . 区别
之间
B . 区别 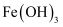 胶体和
胶体和  溶液可利用胶体具有丁达尔效应
C . 向
溶液可利用胶体具有丁达尔效应
C . 向  溶液中滴加饱和的
溶液中滴加饱和的  溶液可制得
溶液可制得 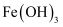 胶体
D . 溶液、液溶胶的分散质的粒子能透过滤纸,悬浊液的分散质的粒子不能透过滤纸
胶体
D . 溶液、液溶胶的分散质的粒子能透过滤纸,悬浊液的分散质的粒子不能透过滤纸
下列说法正确的是( )
A . 强电解质溶液的导电能力一定比弱电解质溶液强
B . 中和等体积、等物质的量浓度的盐酸和醋酸,所需要氢氧化钠的物质的量相同
C . 若盐酸中溶质的物质的量浓度是醋酸中溶质物质的量浓度的2倍,则盐酸中的  也是醋酸中
也是醋酸中  的2倍
D . 物质的量浓度相同的僯酸钠溶液和磷酸中
的2倍
D . 物质的量浓度相同的僯酸钠溶液和磷酸中  的浓度相同
的浓度相同
 也是醋酸中
也是醋酸中  的2倍
D . 物质的量浓度相同的僯酸钠溶液和磷酸中
的2倍
D . 物质的量浓度相同的僯酸钠溶液和磷酸中  的浓度相同
的浓度相同
中华民族为人类文明进步作出了巨大贡献。下列事例用化学观点分析错误的是( )
A . 侯氏制碱法工艺过程中应用了物质溶解度的差异
B . 几千年前用谷物酿酒和酿醋,酿造过程中只发生了水解反应
C . 我国生产陶瓷历史悠久。四川三星堆遗址新出土大量陶瓷碎片,属于无机非金属材料
D . 今年我国科学家在国际上首次实现了从CO2到淀粉的人工合成,过程中包含着氧化还原反应
由下图得出的结论正确的是( )

A . NaCl溶液能导电,是电解质
B . 电解质在电流的作用下才能发生电离
C . 固体NaCl中不存在 和
和 D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
 和
和 D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
D . NaCl溶液中存在自由移动的水合钠离子和水合氯离子
含SO2的工业烟气脱硫往往使用较为廉价的碱性物质如生石灰、浓氨水等吸收。近年来一些近海的煤电厂,利用海水的微碱性(8.0≤pH≤8.3)开发海水脱硫新工艺。主要原理是:SO2与海水生成H2SO3 , H2SO3电离得到 和
和 进一步氧化得到
进一步氧化得到 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(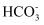 和
和 )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关 、
、 、
、 的说法正确的是( )
的说法正确的是( )
 和
和 进一步氧化得到
进一步氧化得到 。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(
。脱硫后海水酸性增强,与新鲜海水中的碳酸盐(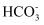 和
和 )发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关
)发生中和反应,最终烟气中的SO2大部分以硫酸盐的形式排入大海。下列有关 、
、 、
、 的说法正确的是( )
的说法正确的是( )
A .  的空间构型为正四面体
B .
的空间构型为正四面体
B .  中碳原子的杂化轨道类型为sp
C .
中碳原子的杂化轨道类型为sp
C .  与
与 中的键角相等
D .
中的键角相等
D .  氧化为
氧化为 , 体现
, 体现 的氧化性
的氧化性
 的空间构型为正四面体
B .
的空间构型为正四面体
B .  中碳原子的杂化轨道类型为sp
C .
中碳原子的杂化轨道类型为sp
C .  与
与 中的键角相等
D .
中的键角相等
D .  氧化为
氧化为 , 体现
, 体现 的氧化性
的氧化性
含有12个中子、最外层电子数为2的某金属元素R的单质2.4g与100mL某浓度的盐酸恰好完全反应,产生标准状况下的氢气2.24L。通过计算分析:(请写出计算过程)
-
(1) R是何种元素?
-
(2) 盐酸的物质的量浓度是多少?
下列有关化学用语表示正确的是( )
A .  的离子结构示意图:
的离子结构示意图: B .
B .  的电子式:
的电子式: C . 乙烯的结构简式
C . 乙烯的结构简式 D . 碳酸氢钠的电离方程式是
D . 碳酸氢钠的电离方程式是
 的离子结构示意图:
的离子结构示意图: 的电子式:
的电子式: D . 碳酸氢钠的电离方程式是
D . 碳酸氢钠的电离方程式是
胶体区别于其他分散系最本质的特征是( )
A . 外观澄清透明
B . 分散质粒子直径的大小
C . 较稳定
D . 有丁达尔现象
下列有关氧化还原反应的说法正确的是( )
A . 金属单质在反应中只能做还原剂,非金属单质只能做氧化剂
B . 金属阳离子被还原不一定得到金属单质
C . 物质中某元素的化合价升高,则该物质只做还原剂
D . 有单质参加的反应都是氧化还原反应
最近更新



