第一单元 物质及其反应的分类 知识点题库
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO  +2I﹣+2H+⇌AsO
+2I﹣+2H+⇌AsO 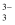 +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
 +2I﹣+2H+⇌AsO
+2I﹣+2H+⇌AsO 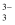 +I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( ) 
A . 甲组操作时,微安表(G)指针发生偏转
B . 甲组操作时,溶液颜色变深
C . 乙组操作时,C2做正极
D . 乙组操作时,C1上发生的电极反应为I2+2e﹣═2I﹣
下列化学式中,只能用来表示一种物质的是( )
A . C2H4Cl2
B . C5H12
C . C
D . C2H5Cl
氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )
A . HCN既是氧化剂又是还原剂
B . CaCN2中含有非极性键
C . CO为氧化产物,H2为还原产物
D . 每消耗5g CaCO3生成1.12L CO2
有五种化合物:①Mg(HCO3)2 , ②Al(OH)3 , ③Al,④(NH4)2CO3 , ⑤Al2O3 . 跟盐酸和NaOH溶液都能反应的物质有( )
A . 二种
B . 三种
C . 四种
D . 五种
复印机工作时易产生臭氧,臭氧浓度过高时对人体有害.臭氧具有强氧化性,可使润湿的KI﹣淀粉试纸变蓝.有关反应式为:O3+2KI+H2O═2KOH+I2+O2对此下列说法正确的是( )
A . 反应中1 mol O3得到4 mol电子
B . 反应中O3是氧化剂,H2O与KI是还原剂
C . 氧化产物I2与还原产物KOH的物质的量之比是1:1
D . 由此反应知,氧化性强弱顺序是O3>I2>O2
铁是世界上用量最大的金属,铁及其化合物在生活、生产中有广泛应用.
请回答下列问题:
-
(1) Fe3O4是磁铁矿的主要成分,Fe3O4可用于制造录音磁带和电讯器材等.高温下,铝粉能与Fe3O4发生铝热反应,该反应的化学方程式为.34.8g Fe3O4与足量稀硝酸反应,被还原HNO3的物质的量为mol.
-
(2) FeCl3溶液是一种黄色透明液体,可用作止血剂,其原因是;向煮沸的蒸馏水中加入几滴饱和FeCl3溶液,继续煮沸得到红褐色的Fe(OH)3胶体,鉴别FeCl3溶液与Fe(OH)3胶体的方法是.
-
(3) 高铁酸钠(Na2FeO4)是一种绿色水处理剂,具有杀菌消毒和聚沉水中杂质的作用,它的杀菌消毒原理是.高铁电池是一种新型可充电电池,高铁电池的总反应为3Zn+2Na2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4NaOH.该电池充电时阳极的电极反应式为
3Zn(OH)2+2Fe(OH)3+4NaOH.该电池充电时阳极的电极反应式为
-
(4) 铁红是一种重要的红色颜料,其主要成分是Fe2O3 , 将一定量的铁红溶于130mL 5mol•L﹣1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L气体(标准状况),向反应后溶液中加入几滴KSCN溶液,溶液不变红色,则参加反应的铁粉质量为.
已知Br2+2Fe2+═2Br﹣+2Fe3+ , 现向含溶质a mol的FeBr2溶液中通入b mol Cl2 , 充分反应.下列说法不正确的是( )
A . 离子的还原性强弱:Fe2+>Br﹣>Cl﹣
B . 当氯气少量时,发生的离子反应:2Fe2++Cl2═2Fe3++2Cl﹣
C . 当a=b时,反应后溶液的离子浓度:c(Fe3+):c(Br﹣):c(Cl﹣)=1:2:2
D . 当氯气过量时,发生离子反应:2Fe2++4Br﹣+3Cl2═2Fe3++2Br2+6Cl﹣
化学与生产、生活、科技等密切相关,下列说法正确的是( )
A . 用石油制取乙烯、丙烯等化工原料不涉及化学变化
B . 高纯硅具有良好的半导体性能,可制光导纤维
C . 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质
D . 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒
NaH(H为-1价)是有机合成中的重要物质之一,其化学性质非常活泼,在潮湿空气中能自燃,有关反应为  =
=  。请回答下列题目:
。请回答下列题目:
 =
=  。请回答下列题目:
。请回答下列题目:
-
(1) 用“双线桥法”标出上述反应中电子转移的方向和数目。
-
(2) 上述反应中,还原剂是,被还原的元素是。反应中每生成1 mol NaOH转移电子mol。
-
(3) NaH 遇水会剧烈反应,生成氢气和一种强碱。请写出该反应的化学方程式。
N2O既是医学上的一种麻醉剂,又是一种常见的温室气体。制取N2O的方法有很多,例如:①NH4NO3=N2O↑+2H2O ②K2SO3+2NO=K2SO4+N2O,
③2NH3+2O2=N2O+3H2O, ④2NaNO3+(NH4)2SO4=2N2O↑+Na2SO4+4H2O等(反应条件均忽略)下列说法正确的是 ( )
A . 、反应①中NH4NO3既是氧化剂又是还原剂,H2O是氧化产物
B . 反应②中K2SO3是还原剂,N2O是氧化产物
C . 反应③中每生成1mol N2O,转移4mol电子
D . 反应④中NaNO3是氧化剂,N2O既是氧化产物又是还原产物
下列有关金属元素特征的叙述正确的是( )
A . 金属元素的原子只有还原性,其阳离子只有氧化性
B . 金属元素的单质在常温下都为固体
C . 含金属元素的离子都是阳离子
D . 金属阳离子被还原不一定得到金属单质
一定条件下,浓硫酸与下列物质发生的反应,不可能是氧化还原反应的是( )
A . 锌
B . 碳
C . 氯化钠
D . 硫化钠
下列关于有关物质的叙述正确的是 ( )
A . 物质所含元素处于最高价态一定具有强氧化性
B . 可以利用金属活动性顺序表判断金属单质的还原性
C . 氧化还原反应的本质是电子的得失
D . 金属单质可以被氧化,也可以被还原
下图是氮元
素形成物质的价类二维图及氮循环的部分信息:
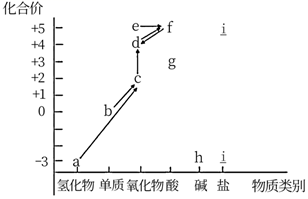
-
(1) 下列说法正确的是
a、可通过雷电作用将b转化为c,这是一种固氮方式
b、可通过加氧化剂将e转化为f
c、a→c→d→f这几个反应中,均发生了N元素被氧化的反应
d、g只具有氧化性,还可能与碱发生反应
e、可通过加Cu、C等还原剂,将f转化为d
f、h可与f反应生成i
-
(2) a的电子式为,写出a转化为c的化学方程式
-
(3) h的化学式是,检验i中阳离子的方法是
-
(4) f的稀溶液与Cu反应的离子方程式为标准状况下生成4.48L气体,参加反应的铜的质量为
为探究  能否氧化
能否氧化  ,某兴趣小组用
,某兴趣小组用  溶液(
溶液(  )和
)和  溶液(
溶液(  )进行如下操作并记录现象。
)进行如下操作并记录现象。
 能否氧化
能否氧化  ,某兴趣小组用
,某兴趣小组用  溶液(
溶液(  )和
)和  溶液(
溶液(  )进行如下操作并记录现象。
)进行如下操作并记录现象。
已知:①  (紫色)
(紫色)
②  遇
遇  无明显现象
无明显现象
③  能显著减慢
能显著减慢  的紫色褪去
的紫色褪去
|
实验编号 |
I |
II |
|
实验操作 |
|
|
|
实验现象 |
溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 |
溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
-
(1) 配制
 溶液时,需要用盐酸酸化,原因是(用化学方程式表示)。
溶液时,需要用盐酸酸化,原因是(用化学方程式表示)。
-
(2) 分析实验I:若向紫色溶液中加入酸,会使体系I中(填离子符号)浓度增大,导致
 平衡正向移动,溶液紫色变深;出现淡黄色浑浊是因为
平衡正向移动,溶液紫色变深;出现淡黄色浑浊是因为  与
与  发生了反应,该反应的离子方程式为。
发生了反应,该反应的离子方程式为。
-
(3) 分析实验II:溶液紫色褪去,是因为
 被(填“氧化”或“还原”)成
被(填“氧化”或“还原”)成  ,该反应的离子方程式为。
,该反应的离子方程式为。
-
(4) 实验I中出现淡黄色浑浊,而实验II中未出现淡黄色浑浊的原因是。
-
(5) 请设计实验方案证明
 反应是有限度的。
反应是有限度的。
碳酸盐在无机试剂制备中应用广泛。某研究小组用如下两种方法制备FeCO3。已知: FeCO3 是白色固体,难溶于水。
-
(1) I.研究小组用炼铁厂的铁矾渣制备FeCO3 , 铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等。

试剂1是过量的,滤渣 2的成分是 (写化学式);
-
(2) “沉铁”发生反应的离子方程式是;
-
(3) 沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),“操作a”是,取28.70g皓矾(ZnSO4·7H2O)加热,剩余固体的质量变化如图,100℃时所得固体的化学式。

-
(4) II.研究小组又采用如下装置制取FeCO3 (C后及夹持装置略)。操作的关键是向Na2CO3溶液(pH=12.11)通入一段时间CO2至溶液pH为7,再滴加一定量FeSO4溶液,产生白色沉淀。

画出装置B,B中所用试剂为;
-
(5) 先向1mol/L Na2CO3溶液中通入CO2的目的是;
-
(6) FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是(不考虑操作不当引起的误差)。
下列各组物质中,第一种是碱,第二种是酸,第三种是混合物( )
A . 硫酸、空气、硫酸铜
B . 纯碱、水、空气
C . 熟石灰、氧化铁、胆矾
D . 烧碱、硝酸、食盐水
一种提纯白磷样品(含惰性杂质)的工艺流程如图所示。下列说法错误的是 ( )

A . 过程Ⅰ中,白磷既做氧化剂又做还原剂
B . 过程Ⅱ中,发生复分解反应
C . 过程Ⅲ中,反应的化学方程式为: D . 理论上,通过本提纯工艺不会产生白磷损失
D . 理论上,通过本提纯工艺不会产生白磷损失
 D . 理论上,通过本提纯工艺不会产生白磷损失
D . 理论上,通过本提纯工艺不会产生白磷损失
-
(1) I.海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

请回答下列问题:
请列举除蒸馏法外海水淡化的一种方法:。
-
(2) 步骤I中,粗盐中含有Ca2+、Mg2+、
 等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)。
A . ①②③④ B . ②③④① C . ②④③① D . ③④②①
等杂质离子,精制时常用的试剂有:①稀盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液。下列加入试剂的顺序正确的是____(填字母)。
A . ①②③④ B . ②③④① C . ②④③① D . ③④②① -
(3) 步骤II已经获得Br2 , 步骤III又将Br2还原为Br- , 其目的是。
-
(4) 写出步骤III反应的离子方程式:。
-
(5) II.海洋植物如海带、海藻中含有丰富的碘元素。碘元素以碘离子的形式存在。实验室从海带中提取碘的流程如下:

灼烧所用仪器有酒精灯、泥三角、(填仪器名称)。
-
(6) 向酸化的滤液中加入过氧化氢溶液,可将I-氧化为I2;请写出该反应的离子方程式:。
下列有关氧化还原反应的叙述中正确的是( )
A . 在反应中不一定所有元素的化合价都发生变化
B . 肯定有一种元素被氧化,另一种元素被还原
C . 非金属单质在反应中化合价只能降低,金属单质在反应中化合价只能升高
D . 氧化还原反应中一定有得氧和失氧的过程
最近更新





