第一单元 物质及其反应的分类 知识点题库
从硫元素的化合价态上判断,下列物质中的硫元素不能表现氧化性的是( )
A . Na2S
B . S
C . SO2
D . H2SO4
下列元素中,属于金属元素的是( )
A . C
B . Cu
C . N
D . Ar
下列物质分类中,前者包括后者的是( )
A . 电解质 石墨
B . 胶体 分散系
C . 混合物 漂白粉
D . 碱性氧化物 CO2
纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹的“脱氯剂”,Na2S2O3和Cl2反应的化学方程式为4Cl2+Na2S2O3+5H2O=2NaCl+2H2SO4+6HCl,有关该反应的说法正确的是( )
A . 该反应中氧化剂是Cl2
B . 该反应是复分解反应
C . 反应中S元素的价态降低
D . 该反应中H2O被氧化
“探险队员”﹣盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则就无法通过.

-
(1) 在能“吃掉”盐酸的化学反应中,属于酸碱中和反应的有个,属于氧化还原反应的有个,其中能“吃掉”盐酸的盐是(填化学式),写出该反应的离子方程式.
-
(2) 在不能与盐酸反应的物质中,属于电解质的是(填写物质序号,下同),属于非电解质的是
-
(3) 请你帮助它走出迷宫(用图中物质前的序号连接起来表示所走的路线)
氢氧化铝是治疗胃酸过多的内服药的主要成分,这是利用了氢氧化铝的( )
A . 弱酸性
B . 弱碱性
C . 两性
D . 不溶解性
将下列物质按酸、碱、盐分类依次排列正确的是( )
A . 硫酸、纯碱、石灰石
B . 氢硫酸、烧碱、绿矾
C . 石炭酸、熟石膏、醋酸钠
D . 磷酸、乙醇钠、苛性钾
已知硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸.
-
(1) 写出并配平上述反应的化学方程式:
-
(2) 反应的还原剂是;它的氧化产物是_.
-
(3) 此反应的离子反应方程式可表示为:
-
(4) 若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有.
硼及其化合物在工业上有许多用途。以铁硼矿( 主要成分为Mg2B2O5·H2O和Fe3O4 , 还有少量 Fe2O3、FeO、CaO、Al2O3 和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
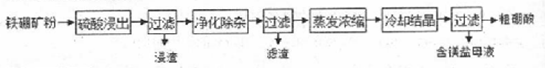
回答下列问题:
-
(1) 写出Mg2B2O5·H2O与硫酸反应的化学方程式。
-
(2) 利用(写化学式,下同)的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是。
-
(3) “净化除杂”需先加H2O2溶液,作用是。
-
(4) 单质硼可用于生成具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程。
某工业生产中有一主要反应:CuFeS2+4Fe3+=5Fe2++Cu2++2S。下列说法正确的是( )
A . 氧化剂为Fe3+ , 还原剂为Cu2+和S2-
B . 氧化产物是S,还原产物是Fe2+和Cu2+
C . 当转移1mol电子时,有46gCuFeS2参加反应
D . 氧化剂的氧化性Fe3+>Fe2+>Cu2+
在下列变化中,需要加入合适的氧化剂才能实现的是( )
A . KMnO4→O2
B . CO2→CO
C . Br-→Br2
D . Fe2O3→Fe
下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A . Ba(OH)2•8H2O与NH4Cl反应
B . 灼热的碳与高温水蒸气的反应
C . 铝与稀盐酸
D . H2与O2的燃烧反应
用双氧水氧化法可处理电镀废水中的氰化物(CN-)和有机添加剂。一定pH下H2O2可使CN-转化为无害的  和N2。现向某废水中加入用量为1.02 mL/L的30%H2O2(密度为1.11 g/mL),处理前后CN-的质量浓度如下表所示,已知该废水中的有机添加剂的耗H2O2量为CN-的3倍。此外过量的H2O2需加入焦亚硫酸钠(Na2S2O5)还原除去。请计算需加入焦亚硫酸钠(Na2S2O5)的量为g/L,(不考虑H2O2的自身分解和溶液体积的变化)写出计算过程。
和N2。现向某废水中加入用量为1.02 mL/L的30%H2O2(密度为1.11 g/mL),处理前后CN-的质量浓度如下表所示,已知该废水中的有机添加剂的耗H2O2量为CN-的3倍。此外过量的H2O2需加入焦亚硫酸钠(Na2S2O5)还原除去。请计算需加入焦亚硫酸钠(Na2S2O5)的量为g/L,(不考虑H2O2的自身分解和溶液体积的变化)写出计算过程。
 和N2。现向某废水中加入用量为1.02 mL/L的30%H2O2(密度为1.11 g/mL),处理前后CN-的质量浓度如下表所示,已知该废水中的有机添加剂的耗H2O2量为CN-的3倍。此外过量的H2O2需加入焦亚硫酸钠(Na2S2O5)还原除去。请计算需加入焦亚硫酸钠(Na2S2O5)的量为g/L,(不考虑H2O2的自身分解和溶液体积的变化)写出计算过程。
和N2。现向某废水中加入用量为1.02 mL/L的30%H2O2(密度为1.11 g/mL),处理前后CN-的质量浓度如下表所示,已知该废水中的有机添加剂的耗H2O2量为CN-的3倍。此外过量的H2O2需加入焦亚硫酸钠(Na2S2O5)还原除去。请计算需加入焦亚硫酸钠(Na2S2O5)的量为g/L,(不考虑H2O2的自身分解和溶液体积的变化)写出计算过程。 | 质量浓度(mg/L) | 处理前 | 处理后 |
| CN- | 5.41 | 0.21 |
铁是人体必需的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁、呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸(主要成分:稀盐酸),服用时同维生素C一起服用效果会更好。某学习小组为了检测“速力菲”药片中Fe2+的存在,设计并进行了如图实验:

请回答下列问题:
-
(1) 试剂1是(填化学式)。
-
(2) 取少量B溶液于试管中,向其滴加NaOH溶液,最初观察到白色絮状沉淀,迅速变为灰绿色,最终变为红褐色,沉淀颜色变化的原因是(用化学方程式表示)。
-
(3) 由B到C过程中溶液出现浅红色现象的原因可能是。
-
(4) 由C到D过程中加入新制氯水,溶液中发生反应的离子方程式是,有同学提出此过程用双氧水代替新制氯水更加合理,理由是。
-
(5) 一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有性。
-
(6) 在上述实验中,同学们发现红色溶液放置一段时间后,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙两位同学对此进行了猜想:
编号
猜想
甲
溶液中的+3价铁又被还原成+2价铁
乙
溶液中的SCN-被过量的新制氯水氧化
你认为(填“甲”或“乙”)同学的猜想更合理。请设计一个简单的实验加以验证你的判断:。
钠能形成多种化合物,如Na2O、Na2O2、Na2CO3、NaHCO3、NaCl、NaOH、NaH等,向答下列下列问题。
-
(1) NaHCO3电离方程式为:,在正盐、含氧酸盐、酸式盐、钠盐等类别中,它不属于其中的。
-
(2) 从性质角度分类,Na2O属于氧化物;写出其与盐酸反应的离子方程式。
-
(3) 区别Na2CO3、NaHCO3两种溶液的试剂是,实验室可利用复分解反应制备少量NaOH,写出相应的化学方程式:。
-
(4) 实验室中可利用Na2O2制取一定量O2 , 写出相应的化学方程式并标出电子转移方向与数目:,Na2O2有强氧化性,能氧化许多物质,将适量Na2O2加入到FeCl2溶液中,除看到有气泡产生后,还能观察到的主要现象是。
已知6HCl+KClO3=KCl+3Cl2↑+3H2O,现将0.1mol KClO3固体与10L 0.6 mol·L-1 盐酸混合充分反应,假设反应后溶液体积仍为10L,下列说法正确的是( )
A . 氧化剂与还原剂物质的量之比为1:6
B . 在标准状况下氧化产物的体积为5.6L
C . 该反应转移电子数为0.6NA
D . 所得混合液中Cl-浓度为0.1mol·L-1
下表是元素周期表的一部分。请按要求回答下列问题:
族 周期 | ⅠA | 0 | ||||||
1 | ④ | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑤ | ⑥ | ||||||
3 | ① | ③ | ⑦ | |||||
4 | ② | ⑧ | ||||||
-
(1) ③对应的元素符号是。⑥元素在周期表第列。
-
(2) 上述所列元素最高价氧化物对应水化物酸性最强的是(填化学式)。
-
(3) 下列说法不正确的是____A . 元素最高正价与最低负价绝对值相等的元素一定处于第ⅣA族 B . 第5周期第VA族元素的原子序数为65 C . ⑥形成的最简单氢化物比⑤形成的最简单氢化物的稳定性高 D . 周期表中当某元素的周期序数大于其族序数时,该元素可能属于金属或非金属
-
(4) 写出由上述所列元素形成的10电子分子的化学式。
-
(5)
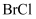 属于卤素互化物,性质与
属于卤素互化物,性质与 相似。写出
相似。写出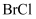 与氢氧化钠溶液反应的化学方程式。
与氢氧化钠溶液反应的化学方程式。
Mn及其化合物在工业生产中具有重要的用途。
-
(1) I.以含MnCO3的矿石为原料,经硫酸溶解得到含Mn2+的溶液,再经一系列处理后进行电解,获得金属Mn。
Mn在(填“阳极”或“阴极”)生成。
-
(2) 阳极泥中含有MnO2 , 写出产生MnO2的电极反应式:。
-
(3) II.阳极泥中除含锰元素外,还含有铅元素,采用如下方法可将它们分别转化为活性MnO2和PbO。
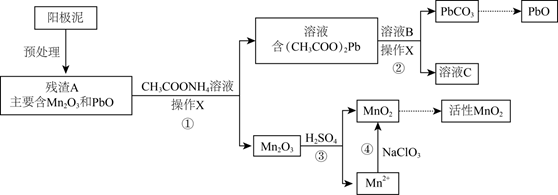
已知:(CH3COO)2Pb在水中难解离。
操作X为。
-
(4) ①中反应的离子方程式为。
-
(5) 滤液C能循环使用,②中溶液B的溶质为。
-
(6) a.为了将③中Mn2O3完全转化为MnO2 , 理论上④中加入的NaClO3与Mn2O3的物质的量之比为(已知NaClO3的还原产物为NaCl)。
b.加入NaClO3前,需将溶液pH调大至6左右。调节pH的目的是。
-
(7) 活性MnO2纯度的测定
i.用V1mLc1mol∙L-1Na2C2O4溶液(H2SO4)酸化)溶解wg活性MnO2样。品。(MnO2+
 +4H+=2CO2↑+Mn2++2H2O)
+4H+=2CO2↑+Mn2++2H2O)ii.用c2mol∙L-1酸性KMnO4标准溶液滴定i中剩余的
 消耗KMnO4标准溶液V2mL。(5
消耗KMnO4标准溶液V2mL。(5  +2
+2  +16H+=2Mn2++10CO2↑+8H2O)
+16H+=2Mn2++10CO2↑+8H2O)样品中MnO2的质量分数=[M(MnO2)=87g·mol-1]。
为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:① ;②
;②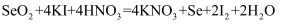 。下列说法错误的是( )
。下列说法错误的是( )
 ;②
;②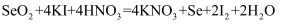 。下列说法错误的是( )
。下列说法错误的是( )
A . 反应①中Se被氧化
B . 反应②中KI是还原剂,HNO3是氧化剂
C . 反应②中,SeO2发生氧化反应
D . 还原性由强到弱的顺序: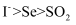
下列物质属于碱性氧化物的是( )
A . CO
B .  C .
C .  D .
D . 
 C .
C .  D .
D . 
最近更新



