专题2 研究物质的基本方法 知识点题库
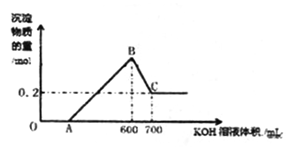
将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL ,4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
-
(1) OA对应反应的离子方程式为,BC对应反应的离子方程式为;
-
(2) c(KOH)=mol/L,混合物中氧化铝的物质的量为mol;
-
(3) A点对应的数值为;
-
(4) 在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是。
-
(5) 向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为。
下列关于 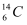 和
和 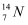 的说法正确的是( )
的说法正确的是( )
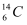 和
和 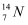 的说法正确的是( )
的说法正确的是( )
A . 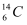 核素中的中子数为8
B .
核素中的中子数为8
B . 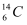 核素中的电子数为8
C .
核素中的电子数为8
C . 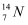 核素中的质子数为14
D .
核素中的质子数为14
D . 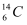 和
和 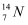 互为同位素.
互为同位素.
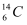 核素中的中子数为8
B .
核素中的中子数为8
B . 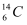 核素中的电子数为8
C .
核素中的电子数为8
C . 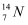 核素中的质子数为14
D .
核素中的质子数为14
D . 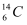 和
和 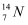 互为同位素.
互为同位素.
下列实验操作要求中,主要是从实验安全方面考虑的是( )
A . 实验剩余的药品不能放回原试剂瓶
B . 点燃可燃性气体前必须验纯
C . 气体实验装置在实验前要进行气密性检查
D . 滴管不能交叉使用
下列对进行焰色反应实验操作注意事项的说明,正确的是( )
①钾的火焰颜色,要透过蓝色钴玻璃观察
②先把铂丝灼烧到与原来火焰颜色相同,再蘸被检物质
③每次实验后,要用硫酸把铂丝洗净
④没有铂丝,也可用光洁无锈的铁丝代替
A . 仅有③不正确
B . 仅有④不正确
C . 仅有②不正确
D . 全对
节日燃放的绚丽焰火与“焰色反应”知识相关。下列说法中正确的是( )
A . 焰色反应均应透过蓝色钴玻璃观察
B . NaCl与Na2CO3灼烧时火焰颜色相同
C . 焰色反应是化学变化
D . 焰色反应后金属丝用硫酸清洗并在外焰上灼烧至没有颜色,再蘸取其他样品灼烧
某原子含有6个电子、7个中子,则它的化学符号可能是( )
A . 13Al
B . 13Al
C . 13C
D . 13C
某化学课外活动小组通过实验探究NO能否与Na2O2反应以及反应后的产物,该活动小组同学设计了如图所示装置(夹持仪器、连接用的乳胶管均已省略)。
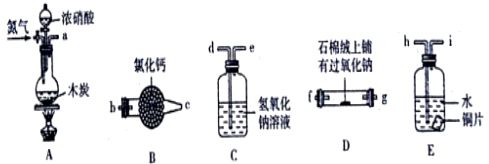
经査阅资料知:①NO是不成盐氧化物;②2NO2+2NaOH =NaNO3+NaNO2+H2O。
回答下列问题:
-
(1) 写出木炭与浓硝酸反应的化学方程式: 。
-
(2) 为了完成实验,同学甲选择上图中的装置,其连接顺序为a→h→i→d→e→b→c→f;但有同学乙认为该装置存在两处缺陷,则该缺陷是、。
-
(3) 按改进后的方案连接,检验装置的气密性,装入药品后,要通入一段时间的氮气,再滴入浓硝酸,点燃酒精灯,通入氮气的主要目的是。
-
(4) 如果将连接顺序h→i→d→e改为d→e→h→i,会产生怎样的后果,请简述。
-
(5) 已知NO与Na2O2反应的产物为NaNO3和NaNO2的混合物,为了测定产物中NaNO2含量,该小组同学准确称取反应后的固体3.50g,用煮沸并冷却后的蒸馏水配成100.00mL溶液,取10.00mL溶液于锥形瓶中,用0.1000mol·L-1KMnO4溶液(硫酸酸化)滴定,共消耗KMnO4溶液20mL。滴定过程中发生反应的离子方程式为,反应产物中NaNO2的质量分数为(保留四位有效数字)
按要求回答问题。
-
(1) 等物质的量的下列有机物完全燃烧,消耗O2最多的是;等质量的下列有机物完全燃烧,消耗O2最多的是。(请填字母)
A.CH4 B.C2H6 C.C3H8 D.C5H12
-
(2) 某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。则A的结构简式是。
-
(1) 有BaCl2和KCl的混合溶液V L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀,消耗a mol H2SO4;另一份滴加AgNO3溶液,消耗b mol AgNO3使Cl-完全沉淀。原混合溶液中的K+的物质的量浓度为mol·L-1。
-
(2) 一定条件下,PbO2与Cr3+反应,产物是
 和Pb2+ , 则与1 mol Cr3+反应所需PbO2的物质的量为mol;
和Pb2+ , 则与1 mol Cr3+反应所需PbO2的物质的量为mol;
-
(3) 在一定条件下,实验室分别以过氧化氢、高锰酸钾、氯酸钾、过氧化钠为原料制取氧气,当制得同温同压下相同体积的氧气时,四个反应中转移的电子数之比为。
-
(4) 自来水中的NO3-对人类健康产生危害。为了降低自来水中NO3-的浓度,某研究人员提出在碱性条件下用Al粉还原NO3- , 产物是N2。发生的反应可表示如下,请完成方程式的配平。Al+NO3-+ —AlO2-+N2↑+H2O,
-
(5) 某化学反应的反应物和产物:KMnO4+KI+H2SO4→MnSO4+I2+KIO3+K2SO4+H2O
①该反应的氧化产物是。
②若该反应方程式中I2和KIO3的计量数分别是是6和3,请在下边的化学式上用单线桥标出电子转移的方向和数目:KMnO4+KI+H2SO4→。
某科研小组利用工业废料(主要成分NiO,含有少量Al2O3、FeO、CuO、BaO)回收NiO,并制备其他部分产品的工艺流程如下:
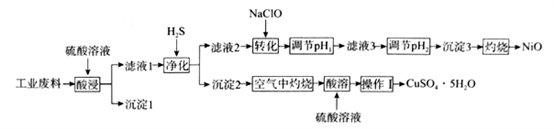
已知:①溶液中离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
②25℃时,部分难溶物的溶度积常数如下表所示:
|
难溶物 |
CuS |
Al(OH)3 |
Ni(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
|
溶度积常数(Ksp) |
6.3×10-36 |
1.3×10-33 |
2.0×10-15 |
4.0×10-38 |
1.8×10-16 |
请回答下列问题:
-
(1) H2S的电子式为。
-
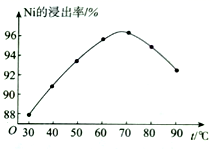
(2) “酸浸”时,Ni的浸出率与温度的关系如图所示。 温度高于70℃,Ni的浸出率降低的主要原因为。
-
(3) “沉淀1”的主要成分为(填化学式)。
-
(4) “滤液1”中通入H2S的作用为。
-
(5) “转化”过程中,发生反应的主要离子方程式为。
-
(6) 25℃时,“调节pH2”使沉淀3中金属阳离子沉淀完全后,所得溶液中的C(H+)最大为(保留三位有效数字,已知
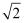 ≈1.4)。
≈1.4)。
-
(7) “操作I”主要包括蒸发浓缩、、过滤、洗涤、干燥。
-
(8) NiO可通过铝热反应冶炼Ni,该反应的化学方程式为。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏高的是( )
A . 定容时观察液面仰视
B . 定容时观察液面俯视
C . 有少量NaOH溶液残留在烧杯中
D . 容量瓶中原来有少量蒸馏水
具有下列核外电子排布式的原子,其半径最大的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
软锰矿中主要含MnO2 , 还含有SiO2、Al2O3;闪锌矿中主要含ZnS,还含有FeS。一种综合利用这两种资源制取Zn、MnO2和Na2SO4的工艺流程如下:
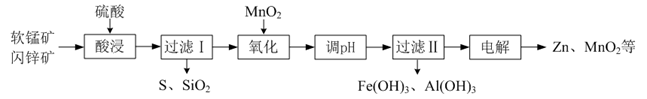
根据以下信息书写反应方程式。
-
(1) 写出“酸浸”时ZnS与MnO2发生反应的化学方程式:。
-
(2) “氧化”的目的是将溶液中的Fe2+转化为Fe3+ , 写出该反应的离子方程式:。
-
(3) “电解”时溶液的pH≈5。写出“电解”时的阳极反应方程式:。
某溶液X中含有H+、  、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、  、Cl−、Br−、
、Cl−、Br−、  、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
 、Na+、Mg2+、Fe2+、
、Na+、Mg2+、Fe2+、  、Cl−、Br−、
、Cl−、Br−、  、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验:
、SiO32-和HCO3-离子中的若干种。取100 mL该溶液进行如下实验: 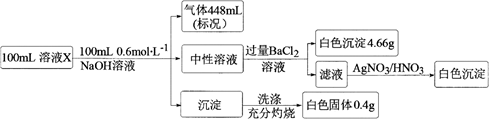
下列说法正确的是( )
A . 溶液X中一定没有  、SiO32- , 可能有Na+、Fe2+
B . 溶液X中加NaOH后,所得沉淀的成分可能有两种
C . 溶液X中c(Cl−)≤0.2 mol·L−1
D . 溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
、SiO32- , 可能有Na+、Fe2+
B . 溶液X中加NaOH后,所得沉淀的成分可能有两种
C . 溶液X中c(Cl−)≤0.2 mol·L−1
D . 溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
 、SiO32- , 可能有Na+、Fe2+
B . 溶液X中加NaOH后,所得沉淀的成分可能有两种
C . 溶液X中c(Cl−)≤0.2 mol·L−1
D . 溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
、SiO32- , 可能有Na+、Fe2+
B . 溶液X中加NaOH后,所得沉淀的成分可能有两种
C . 溶液X中c(Cl−)≤0.2 mol·L−1
D . 溶液X可能是由NH4HSO4、MgCl2按物质的量之比2∶1混合再溶于水配制而成
香花石被誉为“矿石熊猫”,其化学式为X3Y2(ZWR4)3T2。其组成元素均为前20号主族元素,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A . 原子半径:Y>Z>R>T
B . T的气态氢化物的稳定性很高是因为其氢化物分子间有氢键
C . 最高价氧化物对应的水化物碱性:X>Z
D . XR2、WR2两化合物中R的化合价不同
下列有关实验错误的是( )
A . 中和反应反应热的测定,需要准确读取酸碱溶液混合后的最高温度
B . 将4.0g NaOH置于100mL容量瓶中,加水配制1.000mo/LNaOH溶液
C . 除去甲烷中的乙烯,可以依次通过酸性KMnO4溶液、NaOH溶液、浓H2SO4
D . 探究Fe2+能转化为Fe3+ , 可以向FeCl2溶液中依次滴加KSCN溶液、氯水
某化学兴趣小组欲在实验室探究氯气氧化性并模拟工业制取漂白粉,设计如图装置.进行实验:
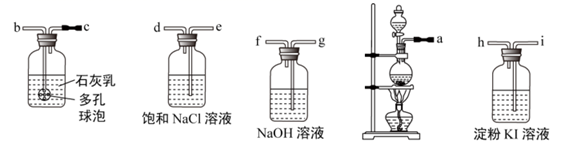
-
(1) 圆底烧瓶中发生反应的离子方程式为.
-
(2) 装置的连接顺序为.
-
(3) 饱和NaCl溶液的作用是,淀粉KI溶液的现象为.
-
(4) 与石灰乳反应制取漂白粉的化学方程式为,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减小副反应发生的方法是.
-
(5) 若用将NaOH溶液换为
 溶液,发生的离子反应方程式为.
溶液,发生的离子反应方程式为.
-
(6) 用下列两种方法制取氯气:①用含氯化氢146g的浓盐酸与足量的二氧化锰反应;②用87g二氧化锰与足量的浓盐酸反应,②中可制得氯气物质的量为,该物质的量比①中制得氯气物质的量(填“多”“少”“一样”).
选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.过滤 B.蒸馏 C.结晶 D.分液 E.萃取
-
(1) 从溴的四氯化碳溶液中提取溴单质。
-
(2) 从硝酸钾和氯化钠的混合溶液中获得硝酸钾。
-
(3) 分离花生油和水的混合液。
-
(4) 用乙醚提取青蒿中的青蒿素。
下列实验装置进行的相应实验,达不到实验目的的是( )
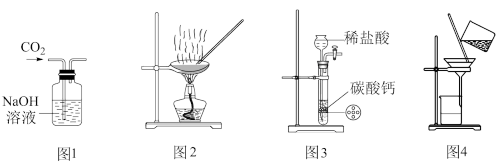
A . 用图1所示装置除去CO2中含有的少量HCl气体
B . 用图2所示装置加热蒸发NaCl饱和溶液制备NaCl晶体
C . 用图3所示装置制取少量CO2气体
D . 用图4所示装置除去少量黄河水中的泥沙
下列关于钠及其化合物的叙述错误的是( )
A . 钠燃烧时发出黄色的火焰
B . 钠有很强的还原性
C .  与
与 都能和水反应生成碱,它们都是碱性氧化物
D . 向
都能和水反应生成碱,它们都是碱性氧化物
D . 向 饱和溶液中通入
饱和溶液中通入 , 有
, 有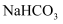 晶体析出
晶体析出
 与
与 都能和水反应生成碱,它们都是碱性氧化物
D . 向
都能和水反应生成碱,它们都是碱性氧化物
D . 向 饱和溶液中通入
饱和溶液中通入 , 有
, 有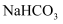 晶体析出
晶体析出
最近更新



