专题2 研究物质的基本方法 知识点题库
-
(1) 基态氮原子的价电子排布式为。
-
(2) 14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为,以“肩并肩”方式形成的共价键数目为。
-
(3) C、N、O三种元素按第一电离能从大到小的排列顺序为。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495kJ·mol-1 , 其第二电离能增幅较大的原因是。
-
(4) 某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和。CrCl3·6NH3有三种异构体,按络离子式量增大的顺序分别是[Cr(NH3)6]Cl3、、[Cr(NH3)4Cl2]Cl·2NH3。
-
(5) NH4N3是高能量度材料,其晶胞如下图所示。N3-是直线型结构,N3-中氮原子的杂化类型是。在VSEPR模型中NH4+的几何构型名称为。

-
(6) 已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA , 则NH4N3的密度为g·cm-3。

-
(1) 将矿石粉碎的目的是,滤渣1的成分是
-
(2) 步骤③先加入足量H2O2溶液,再加MgO调节溶液pH=5,加入足量的H2O2溶液后发生的所有氧化还原反应的方程式为
-
(3) 滤渣2的成分是,1mol该滤渣用3mol/L硫酸溶解,需消耗硫酸mL
-
(4) 列举沉镁之后的滤液的一种用途,称取14.2g的
 在(填仪器名称)中进行高温焙烧得到的MgO质量为8.0g,则x=。
在(填仪器名称)中进行高温焙烧得到的MgO质量为8.0g,则x=。

回答下列问题:
-
(1) 步骤①中部分Cu与稀H2SO4、O2反应,该反应的离子方程为。
-
(2) 步骤②的反应中作氧化剂的物质是。
-
(3) 滤液A含有的金属离子主要有Zn2+、Cu2+、。
-
(4) 步骤④中王水与Au反应生成了HAuCl4、NO和H2O,该反应的化学方程式为。该步骤产生的尾气中有NO,可向尾气中通入适量的空气后,再通入溶液(填一种试剂)中的方法将其除去。
-
(5) 步骤⑤中工业上若加入甲醛脱硝,反应生成CO2、NO和H2O,若加入尿素脱硝则生成N2、CO2和H2O。工业上应选择脱硝,原因是。
-
(6) 若步骤⑥制纯金时反应amolH2C2O4 , 产生bL滤液C。取25.00ml滤液C,加入NaOH溶液中和,再加入足量的CaCl2饱和溶液,得到沉淀,过滤,将沉淀晾干得到CaC2O4 , 固体0.128g。步骤⑥加入的草酸晶体(H2C2O4∙2H2O)的质量至少为g(写出计算式)。

下列说法错误的是( )
| 实验器材 | 相应实验 | |
| ① | 量筒、温度计、烧杯、碎纸条、盖板 | 中和热的测定 |
| ② | 烧杯、分液漏斗 | 用饱和 |
| ③ | 量筒、玻璃捧、烧杯、 | 用浓盐酸配制 |
| ④ | 蒸馏烧瓶、酒精灯、温度计、直形冷凝管、锥形瓶、牛角管、石棉网 | 分离甲醇和甘油的混合物 |
| ⑤ | 坩埚、酒精灯、玻璃棒、泥三角、三脚架 | 从食盐水中得到 |
 的说法中,错误的是( )
的说法中,错误的是( )
 原子核外电子数为15
B .
原子核外电子数为15
B .  原子的质量数为15
C .
原子的质量数为15
C .  可能用于同位素示踪
D .
可能用于同位素示踪
D .  和
和  的化学性质基本相同
的化学性质基本相同
 ,
,  的氢氧化钠溶液,现用固体氢氧化钠进行配置,回答下列问题:
的氢氧化钠溶液,现用固体氢氧化钠进行配置,回答下列问题:
-
(1) 图中仪器中一定不会用到的是(选填仪器符号)。

-
(2) 需要用托盘天平称取氢氧化钠的质量为
-
(3) 配制过程中:
①第一步需要做的是
②定容时,加蒸馏水至刻度线时,改用(填仪器名称(继续滴加蒸馏水至液体凹液面与容量瓶刻度线相切;
-
(4) 判断下列情况对所配制的溶液浓度的影响(选填“偏高”“偏低”或“无影响”)
①称量过程时间用太久
②容量瓶洗涤干净后未干燥

已知:①离子完全沉淀时的pH:  为8,
为8,  为5。
为5。
②常温常压下,CO2饱和溶液的pH为5.6。
③CaCO3、CaSiO3都难溶于水。
回答下列问题:
-
(1) “碱熔”是在高温下进行的,其中CaWO4与纯碱发生反应的化学方程式是。滤渣Ⅰ的化学式是、CaCO3。
-
(2) 检验“除硅”的滤液中不含
 的简单方法是。
的简单方法是。
-
(3) “酸化”过程中Na2WO4溶液加盐酸酸化,变成聚钨酸钠(Na6W12O39)溶液,其离子方程式为。
 常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示: 已知:①
已知:① 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
 、
、 。
。
② 和
和 在水中均可溶,在乙醇中均难溶。若向
在水中均可溶,在乙醇中均难溶。若向 溶液中加入乙醇,会析出
溶液中加入乙醇,会析出 晶体。
晶体。
请回答下列问题:
-
(1) 实验室用下图装置制备合成
 所需的
所需的 溶液。
溶液。
①仪器a的名称是;仪器d中发生反应的离子方程式是。
②说明检验装置A气密性的方法:。
③装置B的加热方法为水浴加热,其优点是。
-
(2) 方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有__(填化学式)杂质,其原因是__(从平衡移动的角度回答)。
-
(3) 方案2的实验步骤为:向
 溶液中加入适量(填试剂名称),过滤、洗涤、干燥。
溶液中加入适量(填试剂名称),过滤、洗涤、干燥。
-
(4) 方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:

减压过滤法相对于普通过滤法的优点为(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
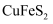 , 含少量
, 含少量 )和软锰矿(主要成分是
)和软锰矿(主要成分是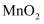 , 含少量
, 含少量 )为原料制备纳米材料MnO和
)为原料制备纳米材料MnO和 的工艺如下:
的工艺如下: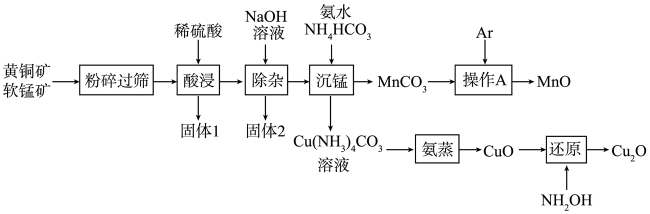
已知:MnO易被氧化。
请回答下列问题:
-
(1) “粉碎过筛”的目的是;“固体1”的主要成分除S外,还有(填化学式)。
-
(2) “除杂”时除掉的离子为(填离子符号)。
-
(3) “沉锰”时生成
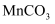 的离子方程式为。
的离子方程式为。
-
(4) 在实验室完成“操作A”时,Ar的作用是。
-
(5) “蒸氨”时发生的是(填“氧化还原反应”或“非氧化还原反应”);“还原”时,每生成1mol
 , 消耗mol
, 消耗mol (
( 被氧化为
被氧化为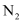 )。
)。
-
(6) 已知黄铜矿中硫元素的质量分数为a%,杂质中不含硫元素和铜元素。wkg这种黄铜矿经上述转化最终得到bg
 , 则铜的提取率为%(填含a、b、w的表达式)。
, 则铜的提取率为%(填含a、b、w的表达式)。注:
 。
。
 溶液除去乙酸乙酯中的乙酸和乙醇
溶液除去乙酸乙酯中的乙酸和乙醇 容量瓶
容量瓶 的稀盐酸溶液
的稀盐酸溶液 晶体
晶体


