专题2 研究物质的基本方法 知识点题库

-
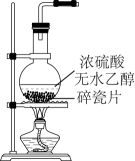
(1) 写出上述图中仪器的名称:①;②;④。
-
(2) 若利用装置Ⅰ分离乙酸(沸点118 ℃)和乙酸乙酯(沸点77.1 ℃)的混合物,还缺少的仪器有,将仪器补充完整后进行的实验操作的名称为;实验时仪器②中冷却水的进口为(填“f”或“g”)。
-
(3) 现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中有两处错误分别是,。
-
(4) 下列关于仪器④的使用方法中,正确的是________(填下列选项的编号字母)。A . 使用前应检查是否漏液 B . 使用前必须烘干 C . 不能用作物质反应或溶解的容器 D . 热溶液可直接转移到其中
-
(5) 下列操作会使配制的溶液浓度偏高的是________(填下列选项的编号字母)。A . 没有将洗涤液转移到容量瓶 B . 转移过程中有少量溶液溅出 C . 摇匀后,液面下降,补充水 D . 定容时俯视刻度线
①取少量溶液,加氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g。
下列说法中正确的是( )
① ![]() 和
和  ②D和T ③甲烷(CH4)与丙烷(C3H8) ④O2与O3 ⑤H2O和H2O2 ⑥
②D和T ③甲烷(CH4)与丙烷(C3H8) ④O2与O3 ⑤H2O和H2O2 ⑥ ![]() 和
和 ![]()
-
(1) 互为同位素的是(填序号,下同)。
-
(2) 互为同素异形体的是。
-
(3) 互为同分异构体的是。
-
(4) 属于同一种物质的是。
-
(1) 下列几组物质中,互为同位素的是,互为同素异形体的是,互为同系物的是,互为同分异构体的是。
①O2和O3;②35Cl和37Cl;③CH3CH3和CH3CH2CH3;④
 和
和  ;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥
;⑤CH3(CH2)2CH3和(CH3)2CHCH3;⑥  和
和  ;⑦
;⑦  和CH3(CH2)3CH3;
和CH3(CH2)3CH3; -
(2) 下列各烷烃的沸点由高到低的顺序为___(用字母表示)A . 正戊烷 B . 异戊烷 C . CH3(CH2)2CH3 D . 新戊烷 E . C3H8
-
(3) 聚乙烯可用于制造食品包装袋,由乙烯制备聚乙烯的化学方程式为。
-
(4) 丙烯中处于同一平面的原子最多有个,丙烯使溴水褪色,其化学方程式为,该反应的类型是。
-
(5) 1mol某烷烃完全燃烧时消耗氧气的物质的量为11mol,其化学式为,其结构中含有3个-CH3的结构简式分别为:。
 、
、  两种离子的核外电子排布相同。下列说法中正确的是( )
两种离子的核外电子排布相同。下列说法中正确的是( )
 半径比
半径比  小
小
-
(1) 取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为L(保留2位小数)。
-
(2) 向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。
-
(1) I.现需要100mL 1.00mol/L NaCl溶液,按如下步骤进行配制:
①计算:需要NaCl固体g;
②称量:用天平精确称量所需要的NaCl固体;
③配制溶液:
④溶解:将称好的NaCl固体放入烧杯中,加入40mL的蒸馏水,用玻璃棒搅拌,使 NaCl固体全部溶解;
⑤转移:将烧杯中的溶液沿玻璃棒注入100mL容量瓶,并用少量蒸馏水洗涤烧杯内壁和 2~3次,将洗涤液也都注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀;
⑥定容:将蒸馏水注入容量瓶,当液面离刻度线1~2cm时,改用胶头滴管,滴加蒸馏水至,盖好瓶塞,反复上下颠倒,摇匀。
-
(2) II.为验证铜和浓硫酸发生反应,并检验气体产物的性质,实验装置图如下。
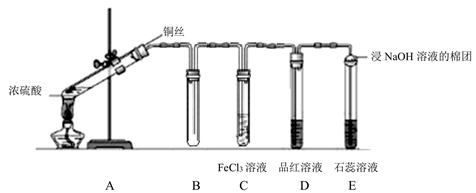
请回答:
浸NaOH溶液棉花团的作用;
-
(3) 下列叙述错误的是_______A . 铜丝下端卷成螺旋状的目的是增大反应接触面积 B . 气体通过D、E试管时的现象依次为溶液红色褪色、溶液先变红后褪色 C . 终止反应后,往试管里慢慢加入少量的水,溶液变成蓝色 D . 实验能说明浓硫酸中硫元素的氧化性强于氢元素
-
(4) 反应过程中,发现装置A试管内有黑色物质生成,经分析可能为Cu2S。产生Cu2S的反应为aCu+bH2SO4
 cCu2S+dCuSO4+eH2O,则a:b=。
cCu2S+dCuSO4+eH2O,则a:b=。

已知如下信息:
①两个羟基连在同一个碳原子上不稳定,易脱去一分子水
② 
回答下列问题:
-
(1) A的化学名称为。
-
(2) 由B生成C的化学方程式为。
-
(3) D中所含官能团的名称为。
-
(4) F的结构简式为,由F生成G的反应类型为。
-
(5) D的芳香族同分异构体W中,每1mol W能与2mol NaOH反应,且芳香环上不超过三元取代的有种(除苯环外不含其它环状结构,且不含C=C=C结构),其中核磁共振氢谱有四组峰的同分异构体的结构简式为。(不考虑立体异构,只需写出1种)

已知:V2O2(OH)4既能与强酸反应,又能与强碱反应。
回答下列问题:
-
(1) V元素在元素周期表中的位置为。
-
(2) “还原酸浸”时,钒以VO2+浸出,“浸出液”中还含有的金属离子是。V2O5被还原的离子方程式为。
-
(3) 常温下,各种形态五价钒粒子总浓度的对数[lgc总(V)]与pH关系如图甲。pH=4时增大钒粒子总浓度,粒子间转化反应的离子方程式为、
 。
。
-
(4) 写出“碱溶”时的化学方程式,结合“碱溶”和“沉钒”可知,ClO
 、VO
、VO 氧化性更强的是
氧化性更强的是
-
(5) 常温下,NH4VO3的溶解度S=0.468 g,则常温下NH4VO3的Ksp= (设NH4VO3饱和溶液的密度为1 g/mL),某研究小组取234 g NH4VO3探究“焙烧”过程中的变化,焙烧过程中减少的质量(
 )随温度变化的曲线如图乙所示,则C点所得物质的化学式为。
)随温度变化的曲线如图乙所示,则C点所得物质的化学式为。
A | B | C | D |
|
|
|
|
制取乙烯 | 提高HClO浓度 | 配制250mL0.10mol·L-1NaOH溶液 | 除去乙烯中的少量SO2 |

回答下列问题:
-
(1) 取200mL废水置于烧杯中,水浴加热至60℃,搅拌的同时按照化学计量数之比加入硫酸铵固体,待其完全溶解后,在低温时搅拌析出铵明矾晶体,其化学式为NH4Al(SO4)2·12H2O,发生反应的化学方程式为。
-
(2) 降温结晶除掉了废水中大部分铝元素,还需将剩余铝、铁元素去除,故降温结晶、过滤后,向滤液中加入X溶液,将废水中的Fe2+完全氧化为Fe3+ , 再调节pH为4.9.根据题意可推知X的电子式为;滤渣1的主要成分是(填化学式)。
-
(3) 工业上常采用有机磷酸类萃取剂P2O4来回收硫酸锌。如果没有设计萃取这一步骤,将会产生的影响是;滤渣2的主要成分是(填化学式);已知Al(OH)3在强碱溶液中生成Al(OH)4]- , 且滤渣2性质类似Al(OH)3 , 请写出滤渣2与强碱溶液反应的离子方程式。
-
(4) 为提高资源利用率,水相经过滤得到的废液可在实验工艺流程中步骤循环使用。
-
(1) 在标准状况下,
 其中含有
其中含有 氧原子。
氧原子。
-
(2) 在标准状况下,
 氨气所占的体积约为L。
氨气所占的体积约为L。
-
(3) 某气态氧化物化学式为
 , 在标准状况下,
, 在标准状况下, 该氧化物的体积是
该氧化物的体积是 , 则氧化物的摩尔质量为。
, 则氧化物的摩尔质量为。
-
(4)
 中含有的氧原子数与
中含有的氧原子数与 个
个 分子含有的氧原子数相同。
分子含有的氧原子数相同。
-
(5)
 分子中所含原子数与
分子中所含原子数与 分子中所含原子数相等。
分子中所含原子数相等。
-
(6) 标准状况下,
 甲烷和一氧化碳的混合气体,其质量为
甲烷和一氧化碳的混合气体,其质量为 , 则混合气体中甲烷的体积为,一氧化碳的质量为。
, 则混合气体中甲烷的体积为,一氧化碳的质量为。
-
(7) 等物质的量的
 和臭氧
和臭氧 , 其质量之比为。
, 其质量之比为。
-
(1) 基态铁原子的价电子排布图为,基态铁原子核外电子的空间运动状态有种, 其处在最高能层的电子的电子云形状为。
-
(2) 一种新研发出的铁磁性材料M的分子结构如图1所示。

①M分子中C、N、O三种元素的电负性由大到小的顺序为。
②M分子中的Fe2+与上下两个五元碳环通过配位键相连且Fe2+共提供了6个杂化轨道,则铁原子最可能的杂化方式为(填序号)。
A.sp2 B.sp3 C.dsp2 D.d2sp3
③分子中的大π键可用符号π
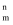 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π ), 则M分子中由碳、氧组成的五元环中的大π键应表示为。
), 则M分子中由碳、氧组成的五元环中的大π键应表示为。 -
(3) 铁氮化合物因其特殊的组成和结构而具有优异的铁磁性能,某铁氮化合物的立方晶胞结构如图2所示。

①若以氮原子为晶胞顶点,则铁原子在晶胞中的位置为。
②该化合物的化学式为,若晶胞中距离最近的铁原子和氮原子的距离为apm,阿伏加德罗常数的值为NA , 则该晶胞的密度为g·cm-3 (列出计算式即可)。
 的物质的量浓度相等的是( )
的物质的量浓度相等的是( )