第一单元 研究物质的实验方法 知识点题库
下列有关实验的选项正确的是( )
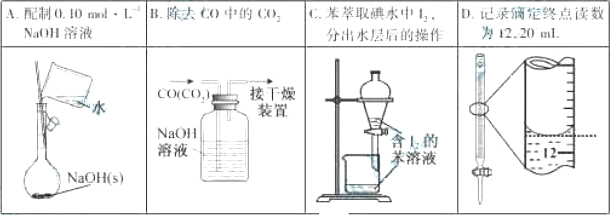
-
(1) Ⅰ锂的原子结构示意图为;锂暴露在湿空气中时,会迅速地失去金属光泽、表面开始变黑,更长时间则变成白色.生成的化合物是氮化锂、氢氧化锂,最终生成碳酸锂.写出生成氮化锂的化学方程式.
-
(2) Ⅱ下面是从锂辉石(Li2O•Al2O3•SiO2)中提出锂的工业流程示意图.
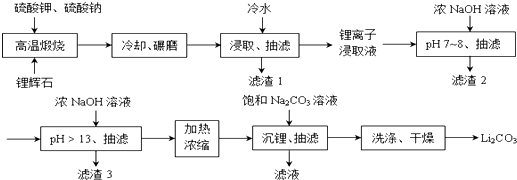
①高温煅烧时的反应原理为:
Li2O•Al2O3•SiO2+K2SO4═K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4═Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+ .
③几种金属离子沉淀完全的pH
金属离子
Al(OH)3
Fe(OH)2
Fe(OH)3
Mn(OH)2
沉淀完全的pH
4.7
9.0
3.2
10.1
④Li2SO4、Li2CO3在不同温度下的溶解度(g/100g水)
温度
溶解度
10℃
20℃
50℃
80℃
Li2SO4
35.4
34.7
33.1
31.7
Li2CO3
1.43
1.33
1.08
0.85
a.浸取时使用冷水的原因是.
b.滤渣2的主要成分为.
c.流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是,用离子方程式表示其产生的原因.
d.加热浓缩的作用是.
e.洗涤Li2CO3晶体使用.
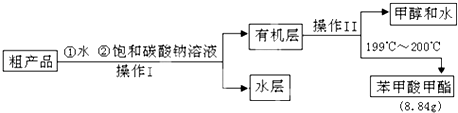
-
(1) 这类物质的相对分子质量与苯酚的相对分子质量之差为的倍数(填数字).
-
(2) 这类物质中相对分子质量最小的物质A的分子式为C7H6O3 . 已知A溶液能与NaHCO3反应放出气体,且能与溴水反应.
①A可能的结构有种.
②现取2.32g苯酚与A的混合物与50.0mL 1.000mol/L的NaOH溶液充分反应后,加水至100mL.取出其中的10.0mL用0.100mol/L的HCl溶液滴定过量的NaOH,消耗20.0mL时至滴定终点.求该混合物中苯酚的质量分数(结果保留三位有效数字)
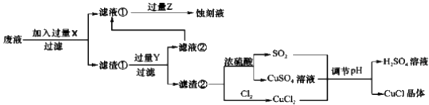
根据以上信息回答下列问题:
-
(1) 写出生产过程中X Y(填化学式).
-
(2) 写出产生CuCl的化学方程式.
-
(3) 在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由.
-
(4) 在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是.
-
(5) 实验探究pH对CuCl产率的影响如表所示:
pH
1
2
3
4
5
6
7
CuCl产率
70
90
82
78
75
72
70
析出CuCl晶体最佳pH为,当pH较大时CuCl产率变低原因是.
-
(6) 氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液250mL于锥形瓶中,充分溶解.
②用0.10mol•L﹣1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2;Fe2++Ce4+═Fe3++Ce3+ . 三次平行实验结果如表(平行实验结果相差不能超过1%):
平行实验次数
1
2
3
0.25g样品消耗硫酸铈标准溶液的体积(mL)
24.35
24.05
23.95
则样品中CuCl的纯度为(结果保留三位有效数字).
| 选项 | 仪器 | 实验目的 |
| A | 分液漏斗 | 分离互不混溶的液体 |
| B | 普通漏斗 | 分离固体与液体 |
| C | 天平 | 称量一定质量的固体 |
| D | 烧杯 | 准确量取一定体积的液体 |
 B .
B . 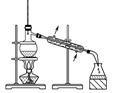 D .
D . 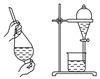
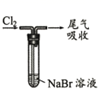 证明Cl2氧化性强于Br2
B .
证明Cl2氧化性强于Br2
B .  分离乙醇和水
C .
分离乙醇和水
C .  除去水中泥沙
D .
除去水中泥沙
D .  配制100mL0.100mol/LNaCl溶液
配制100mL0.100mol/LNaCl溶液
| 物理性质 | 熔点℃ | 沸点℃ | 密度g∙cm-3 |
| 甲苯 | -95 | 110 | 0.86 |
| 一氯化苄(C6H5CH2Cl) | -45 | 179 | 1.10 |
| 二氯化苄(C6H5CHCl2) | -17 | 205 | 1.26 |
| 三氯化苄(C6H5CCl3) | -4.4 | 221 | 1.37 |
回答下列问题:
-
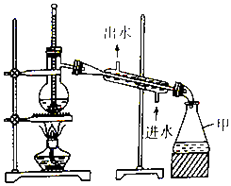
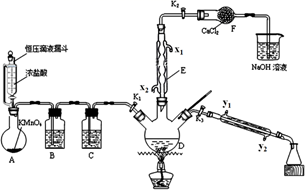
(1) 仪器F的名称是;
-
(2) 瓶B和C中盛放的试剂应分别为(填序号);
a.蒸馏水;浓硫酸 b.饱和食盐水;浓硫酸
c.浓硫酸;酸性KMnO4溶液 d.饱和NaHCO3溶液;浓硫酸
-
(3) 两处冷凝水的进水口应分别为(填序号);
a.x1、y1
b.x1、y2
c.x2、y1
d.x2、y2
-
(4) 在回流反应的过程中,由于温度控制不当,部分产物从K2处被蒸出。取烧杯中的少量吸收液于试管中,滴入新制氢氧化铜悬浊液并加热,观察到有砖红色沉淀生成。则在吸收液中发生反应的化学方程式为;
-
(5) 反应结束后,撤去E、F及尾气吸收装置,插上玻璃塞。保持K1关闭,打开K3 , 加热三颈烧瓶,分馏出一氯化苄,应选择的温度范围是;
-
(6) 由于某同学操作时不慎将含铁的沸石加入三颈烧瓶,在分馏时得到了异常馏分X。用质谱法测得X的相对分子质量与二氯化苄相同,核磁共振氢谱显示X中有3种不同化学环境的氢。已知苯环上存在甲基或氯甲基是,后续取代苯环的基团主要引入其邻位或对位,X的结构简式可能为。
请回答:
-
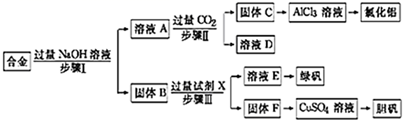
(1) 写出步骤Ⅱ中生成固体C的离子方程式:。步骤Ⅲ中试剂X是
-
(2) 进行步骤Ⅱ时,该小组用如图所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是。
-
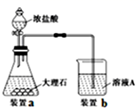
(3) 用固体F制备CuSO4溶液,可设计如图三种途径:

写出途径②中反应的化学方程式:。
-
(4) 用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为。
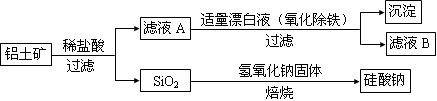
-
(1) 在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
Fe2++ClO-+=Fe(OH)3↓+Cl-+
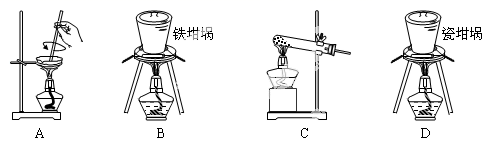
-
(2) SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。
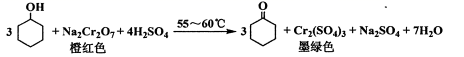
已知:反应时强烈放热;过量氧化剂会将环己醇氧化为己二酸。
| 物质 | 相对分子质量 | 沸点/℃ | 密度/(g∙cm-3 , 20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
实验步骤:
I.配制氧化液:将5.5g重铬酸钠配成溶液,再与适量浓硫酸混合,得橙红色溶液,冷却备用。
II.氧化环己醇:向盛有5.3mL环己醇的反应器中分批滴加氧化液,控制反应温度在55~60℃,
搅拌20min。
III.产物分离:向反应器中加入一定量水和几粒沸石,改为蒸馏装置,馏出液为环己酮和水的混合液。
IV.产品提纯:馏出液中加入NaCl至饱和,分液,水相用乙醚萃取,萃取液并入有机相后加入无水MgSO4干燥,水浴蒸除乙醚,改用空气冷凝管蒸馏,收集到151~156℃的馏分2.5g。
回答下列问题:
-
(1) 铬酸钠溶液与浓硫酸混合的操作是。
-
(2) 氧化装置如图所示(水浴装置略):
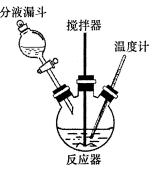
①反应器的名称是;控制反应温度在55~60℃的措施除分批滴加氧化液外,还应采取的方法是。
②温度计示数开始下降表明反应基本完成,此时若反应混合物呈橙红色,需加入少量草酸,目的是 。
-
(3) 产品提纯时加入NaCl至饱和的目的是,分液时有机相从分液漏斗的(填“上”或“下”)口流出(或倒出);用乙醚萃取水相的目的是。
-
(4) 由环已醇用量估算环己酮产率为。
 ClCH2COOH+HCl
ClCH2COOH+HCl
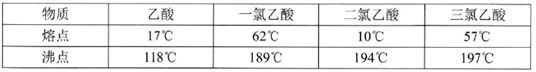
已知:
请回答下列问题:
-
(1) 将18.0 g乙酸放入三颈烧瓶中,并加入适量的硫做催化剂,并选用下图的装置制备一氯乙酸粗品。
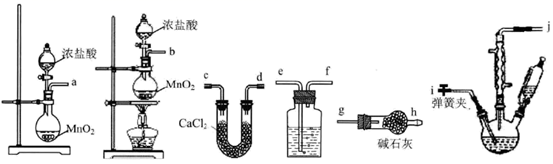
①按照气流从左至右依次连接的合理顺序为→→→→i→j→g→h(填接口字母)。
②实验室里也可使用高锰酸钾与浓盐酸反应制取Cl2 , 其反应的化学方程式为。
③洗气瓶中的溶液为,碱石灰的作用是。
-
(2) 制备一氯乙酸时,首先采用(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹,然后打开活塞滴加浓盐酸并点燃酒精灯,如果三颈烧瓶溶液表面观察到大量黄绿色气体时,应该(填操作),以减少氯气通入量,以免浪费。
-
(3) 一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有杂质,杂质中含量较多的是(填物质名称),经提纯后得到纯净的一氯乙酸14.6 g,则一氯乙酸的产率为(精确到小数点后一位)。
| 选项 | 实验操作 | 实验现象或结论 |
| A | 把一小块钠迅速投入到热坩埚中,继续加热坩埚片刻 | 钠受热后熔成小球,剧烈燃烧,火焰呈黄色,产物为淡黄色固体 |
| B | 把小块钠投入到滴有紫色石蕊试液的盛冷水中 | 钠熔化成闪亮的小球,在水面上四处游动,有“嘶嘶”的响声发出,反应后溶液变红 |
| C | 将有色鲜花放入盛有干燥氯气的集气瓶中,盖上玻璃片 | 鲜花褪色,证明氯气具有漂白性 |
| D | 用洁净铂丝蘸取溶液,在酒精喷灯外焰上灼烧,观察到火焰呈黄色 | 溶液中一定存在 Na+ ,不存在 K+ |
 溶液,过滤,加酸后于冰水中得到较纯产品
D . 碘的萃取实验中,苯分批加入萃取效果优于一次性加入
溶液,过滤,加酸后于冰水中得到较纯产品
D . 碘的萃取实验中,苯分批加入萃取效果优于一次性加入
选项 | 实验操作 | 现象 | 结论 |
A | 向某溶液中先加入几滴KSCN溶液,再通入氯气 | 开始无明显现象,后溶液变红 | 溶液中一定含Fe2+ , 一定不含Fe3+ |
B | 向BaCl2 溶液中通入SO2气体 | 有白色沉淀生成 | 该白色沉淀为BaSO3 |
C | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性: S>C |
D | 在火焰上灼烧搅拌过某无色溶液的铂丝 | 火焰出现黄色 | 该溶液一定是钠盐溶液 |



