第二单元 硫及其化合物的相互转化 知识点题库
酸性条件下,可用某些盐溶液吸收水煤气中的少量H2S,以回收硫元素、降低污染.欲达到该目的,下列试剂中最合适的是( )
A . KClO3
B . FeCl2
C . HNO3
D . FeCl3
某实验小组为探究ClO﹣、I2、SO  在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
 在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下: 实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4 , 溶液立即变蓝;
实验②:向实验①的溶液中加入4L 0.5mol/L的Na2SO3溶液,发生反应如下
SO  +I2+H2O→SO
+I2+H2O→SO  +I﹣+H+(未配平),恰好完全反应.
+I﹣+H+(未配平),恰好完全反应.
-
(1) 以上实验说明,在酸性条件下ClO﹣、I2、SO42﹣的氧化性由弱到强的顺序是.
-
(2) 实验②中化学反应转移电子的物质的量是.
-
(3) 写出实验①中发生反应的离子方程式.
下列装置或操作不能达到实验目的是( )
A .  比较Cl2、Fe3+、I2的氧化性
B .
比较Cl2、Fe3+、I2的氧化性
B . 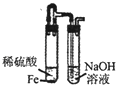 制取Fe(OH)2
C .
制取Fe(OH)2
C . 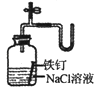 证明铁生锈时空气参加反应
D .
证明铁生锈时空气参加反应
D .  检查装置气密性
检查装置气密性
 比较Cl2、Fe3+、I2的氧化性
B .
比较Cl2、Fe3+、I2的氧化性
B .  制取Fe(OH)2
C .
制取Fe(OH)2
C .  证明铁生锈时空气参加反应
D .
证明铁生锈时空气参加反应
D .  检查装置气密性
检查装置气密性
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A . 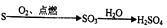 B .
B . 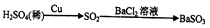 C .
C . 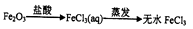 D .
D . 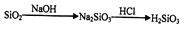
将Cu片放入0.1mol/L的 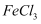 溶液中,一段时间后取出
溶液中,一段时间后取出  片,溶液中
片,溶液中  ,则
,则 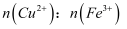 为( )
为( )
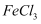 溶液中,一段时间后取出
溶液中,一段时间后取出  片,溶液中
片,溶液中  ,则
,则 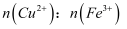 为( )
为( )
A . 3:4
B . 3:5
C . 4:3
D . 3:2
已知反应: ①Cl2+2KBr=2KCl+Br2 , ②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3 , 下列说法正确的是 ( )
A . 上述3个反应都是置换反应
B . ③中1 mol 氧化剂参加反应得到电子的物质的量为10 NA
C . 反应②中若得到13.44L Cl2 , 则电子转移个数为6.02×1023
D . 氧化性由强到弱的顺序为: KBrO3 > KClO3 > Cl2 > Br2
一定条件下,下列各组物质能一步实现 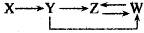 转化关系的是( )
转化关系的是( )
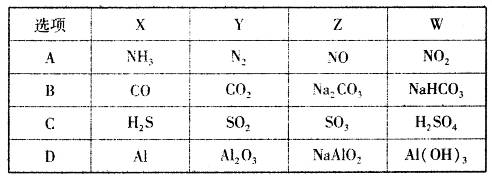
A . A
B . B
C . C
D . D
-
(1) Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中Na2O2 是(填氧化剂、还原剂),与CO2反应的化学反应方程式。
-
(2) 湿法制备高铁酸钾的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:。
②若反应过程中转移了0.3mol电子,则还原产物的物质的量为mol。
-
(3) Ⅱ.已知:2Fe3++2I-=2Fe2++I2 , 2Fe2++Br2=2Fe3++2Br-。
含有1 mol FeI2和2 mol FeBr2的溶液中通入2 mol Cl2 , 此时被氧化的离子是。
-
(4) 若向含a mol FeI2和b mol FeBr2的溶液中通入c mol Cl2 , 当I-、Fe2+、Br-完全被氧化时,c=(用含a、b的代数式表示)。
为防止废弃的硒单质(Se)造成环境污染,通常用浓硫酸将其转化成二氧化硒(SeO2),再用KI溶液处理后回收Se。发生的反应为:①Se+2H2SO4(浓)=2SO2+SeO2+2H2O、②SeO2+4KI+4HNO3=4KNO3+Se+2I2+2H2O,下列说法错误的是( )
A . ①中SO2是还原产物,SeO2是氧化产物
B . ②中KI是还原剂,HNO3是氧化剂
C . 每生成0.4molI2共转移1.2mol电子
D . 氧化性由强到弱的顺序是:H2SO4(浓)>SeO2>HNO3
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A . 在含AlO2-、SO32-、OH-的溶液中逐滴加入硫酸氢钠溶液:OH-、AlO2-、SO32-
B . 含等物质的量的FeBr2、FeI2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C . 含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
D . 在含Fe3+、H+、NH4+的溶液中逐渐加入烧碱溶液:H+、NH4+、Fe3+
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是( )
A . 滴加KI溶液时,转移2mol电子时生成1mol白色沉淀
B . 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C . 通入SO2时,SO2与I2反应,I2作还原剂
D . 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
已知某物质X能发生如下转化:

下列有关上述转化关系中物质及其反应的叙述错误的是( )
A . 若X为N2 , 则A为硝酸
B . 若X为S,则A为硫酸
C . 反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
D . 若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
3Na2S+4H2SO4(浓)=3Na2SO4+4S↓+4H2O,氧化剂与还原剂的物质的量之比为( )
A . 3:4
B . 4:3
C . 1:3
D . 3:1
工业尾气中含有的SO2对环境有害,采取合理的方法可以将其转化为硫化钙、硫酸钾等有用的物质。其一种转化路线如图所示:
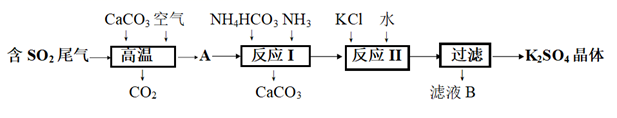
-
(1) 提高尾气中SO2的去除率,在高温反应时可采用的常用措施是,得到的固体产物A是(写化学式)。
-
(2) 反应Ⅰ的化学方程式为,该反应需在60℃~70℃下进行,温度不能高于70℃的原因除了减少氨气挥发外还有。
-
(3) 固体A与过量焦炭一起焙烧生成CaS,该反应的化学方程式。
-
(4) 滤液B中除K+、SO
 离子外,大量存在的的离子还有。
离子外,大量存在的的离子还有。
硫酰氯(SO2Cl2)可用于有机合成和药物制造等。实验室利用SO2和Cl2在活性炭作用下制取SO2Cl2[SO2(g)+Cl2(g)  SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是( )
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是( )
 SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是( )
SO2Cl2(l) ΔH= -97.3kJ/mol],装置如图所示(部分装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法错误的是( ) 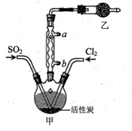
A . 乙装置中盛放的试剂是P2O5 , 防止水蒸气进入装置中
B . 装置甲应置于冰水浴中,目的是提高SO2Cl2产率
C . 反应结束后,分离甲中混合物的实验操作是蒸馏
D . SO2、Cl2均可使品红试液褪色,原理不相同
在给定条件下,下列物质间转化能实现的是( )
A . S  SO2
SO2  H2SO3
B . NH3
H2SO3
B . NH3  NO2
NO2  HNO3
C . Fe2O3
HNO3
C . Fe2O3  Fe
Fe  FeCl3
D . Al
FeCl3
D . Al  NaAlO2
NaAlO2  Al(OH)3
Al(OH)3
 SO2
SO2  H2SO3
B . NH3
H2SO3
B . NH3  NO2
NO2  HNO3
C . Fe2O3
HNO3
C . Fe2O3  Fe
Fe  FeCl3
D . Al
FeCl3
D . Al  NaAlO2
NaAlO2  Al(OH)3
Al(OH)3
已知甲、乙、丙三种物质均含有同种元素,其转化关系如下(反应条件已略去)。
![]()
下列推断错误的是( )
A . 若丙为红棕色气体,则甲可能为  B . 若丙为
B . 若丙为  ,则X与稀盐酸反应可以得到丙
C . 若乙为
,则X与稀盐酸反应可以得到丙
C . 若乙为  ,则甲可能是
,则甲可能是  D . 若乙能使品红溶液褪色,则甲一定是S单质
D . 若乙能使品红溶液褪色,则甲一定是S单质
 B . 若丙为
B . 若丙为  ,则X与稀盐酸反应可以得到丙
C . 若乙为
,则X与稀盐酸反应可以得到丙
C . 若乙为  ,则甲可能是
,则甲可能是  D . 若乙能使品红溶液褪色,则甲一定是S单质
D . 若乙能使品红溶液褪色,则甲一定是S单质
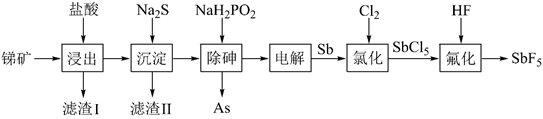
五氟化锑( 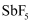 )是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为  ,含有少量CuO、PbO、
,含有少量CuO、PbO、  等杂质)为原料制备
等杂质)为原料制备 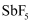 的工艺流程如图。
的工艺流程如图。
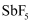 )是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸其酸性是纯硫酸的1500万倍。以某矿(主要成分为  ,含有少量CuO、PbO、
,含有少量CuO、PbO、  等杂质)为原料制备
等杂质)为原料制备 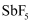 的工艺流程如图。
的工艺流程如图。
已知:I.CuS、PbS的Ksp分别为 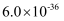 、
、 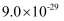
Ⅱ.  微溶于水、
微溶于水、  难溶于水,它们均为两性氧化物;SbOCl难溶于水。
难溶于水,它们均为两性氧化物;SbOCl难溶于水。
回答下列问题:
-
(1) 浸出时少量
 转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为
转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为  ,该反应的离子方程式为
,该反应的离子方程式为
-
(2) “除砷”时,
 转化为
转化为  ,该反应的离子方程式为
,该反应的离子方程式为
-
(3)
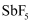 与
与 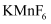 反应,首次实现了用化学方法制取F2 , 同时生成
反应,首次实现了用化学方法制取F2 , 同时生成 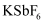 和
和  ,化学反应方程式为
,化学反应方程式为
-
(4) 已知

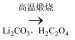 LiFePO4 , 写出该反应的化学方程式
LiFePO4 , 写出该反应的化学方程式
二氧化硫 是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
 是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
是大气主要污染物脱硫是环境治理的热点问题。回答下列问题。
-
(1) 利用
 吸收
吸收 的离子方程式为:
的离子方程式为:
 +□ (在“□”里填入系数在“ ”上填入微粒符号),加入
+□ (在“□”里填入系数在“ ”上填入微粒符号),加入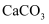 可以提高
可以提高 去除率,原因是。
去除率,原因是。 -
(2) 工业上还常用氨水吸收法处理
 , 可生成
, 可生成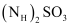 或
或 。
。
①
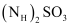 显碱性,结合化学用语,用化学平衡原理解释其原因:。
显碱性,结合化学用语,用化学平衡原理解释其原因:。②
 显酸性。用氨水吸收
显酸性。用氨水吸收 , 当吸收液显中性时溶液中离子浓度关系正确的是(填字母)。
, 当吸收液显中性时溶液中离子浓度关系正确的是(填字母)。a.

b.
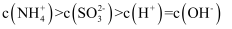
c.

-
(3) 某工厂烟气中主要含
 、
、 , 在较高温度经下图所示方法脱除
, 在较高温度经下图所示方法脱除 并制得
并制得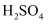 。
。
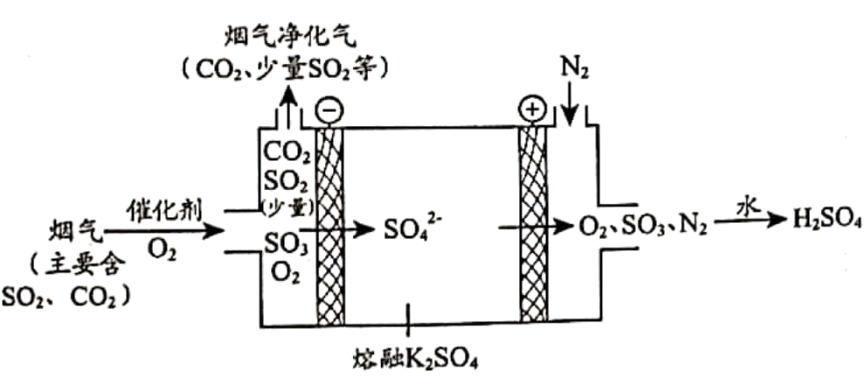
①在阴极放电的物质是。
②在阳极生成
 的电极反应式是。
的电极反应式是。
下列说法涉及物质的氧化性或还原性的是( )
A . 用葡萄糖制镜
B . 用硫酸铝净水
C . 用小苏打作食品膨松剂
D . 用氟化物添加在牙膏中预防龋齿
最近更新



