第二单元 硫及其化合物的相互转化 知识点题库
下列关于硫化氢或氢硫酸的描述,错误的是( )
A . 硫化氢易溶于水,可做喷泉实验
B . 硫化氢是一种弱酸,它具有酸的通性
C . 硫化氢燃烧时,发出淡蓝色火焰
D . 硫化氢受热易分解生成两种单质
根据下列化学方程式:
①2MnO4﹣+16H++10Cl﹣═2Mn2++5Cl2↑+8H2O
②2Fe2++Cl2═2Fe3++2Cl﹣
③2Fe3++Cu═2Fe2++Cu2+
④Fe+Cu2+═Fe2++Cu
可判断MnO4﹣、Cu2+、Fe3+、Cl2的氧化性由强到弱的顺序为( )
A . Fe3+>MnO4﹣>Cl2>Cu2+
B . MnO4﹣>Cl2>Fe3+>Cu2+
C . Cl2>MnO4﹣>Fe3+>Cu2+
D . Cu2+>Cl2>MnO4﹣>Fe3+
铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知下列反应在一定条件下能够发生:(1)Tl3++2Ag=Tl++2Ag+ , (2)Ag++Fe2+=Ag+Fe3+ , (3)Fe+2Fe3+=3Fe2+ , 下列离子氧化性比较顺序正确的是 ( )。
A . Tl3+>Fe3+>Ag+
B . Fe3+>Ag+>Tl3+
C . Tl+>Ag+>Fe2+
D . Tl3+>Ag+>Fe3+
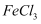 、
、 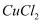 的混合溶液中加入铁粉,充分反应后仍有固体剩余,则下列判断错误的是( )
的混合溶液中加入铁粉,充分反应后仍有固体剩余,则下列判断错误的是( )
A . 加入KSCN溶液一定不变红色
B . 溶液中一定含有  C . 溶液中一定含有
C . 溶液中一定含有 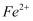 D . 剩余固体中一定含有
D . 剩余固体中一定含有 
 C . 溶液中一定含有
C . 溶液中一定含有 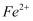 D . 剩余固体中一定含有
D . 剩余固体中一定含有 
已知Cu2O能与稀硝酸反应:Cu2O+HNO3→Cu(NO3)2+NO↑+H2O(未配平),若生成的NO在标况下的体积为0.448L,下列说法正确的是( )
A . 转移的电子总数为0.06NA
B . 作氧化剂的HNO3是0.14mol
C . 至少需要0.5mo/L的硝酸140mL与Cu2O反应
D . 被氧化的Cu2O是144g
下列各反应中,水作为还原剂的是( )
A . 2H2+O2  2H2O
B . SO3+H2O=H2SO4
C . 2F2+2H2O=4HF+O2
D . 2Na+2H2O=2NaOH+H2 ↑
2H2O
B . SO3+H2O=H2SO4
C . 2F2+2H2O=4HF+O2
D . 2Na+2H2O=2NaOH+H2 ↑
常温下,在溶液中可以发生反应X+2Y3+=2Y2++X2+ , 则下列叙述中①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强,正确的是( )
A . ②④⑥
B . ①③④
C . ①③⑤⑥
D . ②⑤
将SO2通入足量Fe2(SO4)3溶液中,完全反应后再加入K2CrO4溶液,发生的两个化学反应为①SO2+2Fe3++2H2O→  +2Fe2++W,②
+2Fe2++W,②  +aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是( )
+aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是( )
 +2Fe2++W,②
+2Fe2++W,②  +aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是( )
+aFe2++bH+→Cr3++Fe3++H2O。下列有关说法正确的是( )
A . 还原性:Cr3+>SO2
B . 方程式②中,a=6,b=7
C .  能将Na2SO3氧化成Na2SO4
D . 方程式①中W为OH−
能将Na2SO3氧化成Na2SO4
D . 方程式①中W为OH−
 能将Na2SO3氧化成Na2SO4
D . 方程式①中W为OH−
能将Na2SO3氧化成Na2SO4
D . 方程式①中W为OH−
根据下列反应,推断氧化性强弱顺序正确的是( )
①2Fe2++Cl2=2Fe3++2 Cl-
②HClO+HCl=Cl2↑+H2O
③Cu+2Fe3+=2Fe2++Cu2+
A . Cl2>HClO>Cu2+
B . HClO>Cl2>Fe3+
C . Cl2>Cu2+>Fe3+
D . Fe3+>Cu2+>HClO
根据相关的化学原理,下列因果判断正确的是( )
A . 由于水中存在氢键,所以稳定性:H2O>H2S
B . 由于Cl的非金属性比S的非金属性强,所以酸性:HClO>H2SO4
C . 若A2+ 2D- = 2A- + D2 , 则氧化性D2>A2
D . 若R2—和M+的电子层结构相同,则离子半径R2—>M+
复印机工作时易产生臭氧,臭氧浓度过高时对人体有害.臭氧具有强氧化性,可使润湿的KI-淀粉试纸变蓝.有关反应式为:O3+2KI+H2O=2KOH+I2+O2对此下列说法正确的是( )
A . 反应中1mol O3得到4mol电子
B . 反应中O3是氧化剂,H2O与KI是还原剂
C . 氧化产物I2与还原产物KOH的物质的量之比是1:1
D . 由此反应知,氧化性强弱顺序是O3>I2>O2
PbO2、KMnO4、Cl2、FeCl3、CuCl2的氧化性依次减弱。下列反应在水溶液中不可能发生的是( )
A . Cu+2Fe3+=Cu2++2Fe2+
B . 10Cl-+2MnO4-+16H+=2Mn2++5Cl2↑+8H2O
C . 2Fe2++Cl2=2Fe3++2Cl-
D . 5Pb2++2MnO4-+2H2O=5PbO2+2Mn2++4H+
单质到盐的转化关系可表示为:
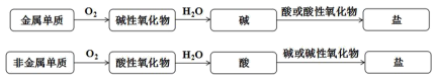
下述转化关系错误的是( )
A . Na  Na2O
Na2O  NaOH
NaOH  CH3COONa
B . Mg
CH3COONa
B . Mg  MgO
MgO  MgCl2
MgCl2 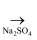 MgSO4
C . C
MgSO4
C . C  CO2
CO2  H2CO3
H2CO3  CaCO3
D . S
CaCO3
D . S  SO2
SO2  H2SO3
H2SO3  Na2SO3
Na2SO3
 Na2O
Na2O  NaOH
NaOH  CH3COONa
B . Mg
CH3COONa
B . Mg  MgO
MgO  MgCl2
MgCl2 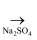 MgSO4
C . C
MgSO4
C . C  CO2
CO2  H2CO3
H2CO3  CaCO3
D . S
CaCO3
D . S  SO2
SO2  H2SO3
H2SO3  Na2SO3
Na2SO3
工业上曾经通过反应“3Fe + 4NaOH  Fe3O4 + 2H2↑+ 4Na↑”生产金属钠。下列说法正确的是( )
Fe3O4 + 2H2↑+ 4Na↑”生产金属钠。下列说法正确的是( )
 Fe3O4 + 2H2↑+ 4Na↑”生产金属钠。下列说法正确的是( )
Fe3O4 + 2H2↑+ 4Na↑”生产金属钠。下列说法正确的是( )
A . 还原产物是钠Na和Fe3O4
B . 用磁铁可以将Fe与Fe3O4分离
C . 将生成的气体在空气中冷却可获得钠
D . 每生成1 mol H2 , 该反应转移的电子数约为4×6.02×1023
已知反应:
①SO3+H2O=H2SO4 ②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2 ④2Na+2H2O=2NaOH+H2↑
⑤Na2O+2HCl=2NaCl+H2O ⑥SiO2+2NaOH=Na2SiO3+H2O
-
(1) 上述反应中,不属于氧化还原反应的是(填序号,下同)。H2O被氧化的是;H2O被还原的是;属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是。
-
(2) 用双线桥法标出反应②中电子转移的方向和数目: 。
-
(3) 用单线桥法标出反应③中电子转移的方向和数目:。
-
(4) 写出反应⑥的离子方程式: 。
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆ClO2。其变化可表示为KClO3
+HCl(浓) →KCl +ClO2↑ +Cl2↑ +H2O。
-
(1) 请完成该化学方程式并配平:
KClO3 +HCl(浓) →KCl +ClO2↑ +Cl2↑ +H2O
-
(2) 此反应的还原剂是,它的氧化产物是;
-
(3) 浓盐酸在反应中显示出来的性质是 。标准状况下,产生33.6L的Cl2 , 则转移的电子的物质的量为 mol。
酸雨的危害很大,能直接破坏农作物、腐蚀建筑物,还会危害人体健康。SO2、NOx是形成酸雨的主要物质,研究SO2、NOx等对减少酸雨,改善空气质量具有重要意义。请回答下列问题:
-
(1) 酸雨是指pH的雨水。
-
(2) NOx主要来源于汽车尾气。硝酸型酸雨的形成过程中涉及的化学方程式有:①
 ;②
;② 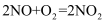 ;③。
;③。
-
(3) SO2主要是煤、石油等燃烧产生,为减少SO2的排放,可采取下列有效措施:
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是。
②在一定条件下用CO还原SO2得到单质硫的方法来除去SO2 , 该反应的化学方程式为。
③用氨水将SO2转化为NH4HSO3 , 再氧化成
 来脱除烟气中的SO2 , 原理是、(用离子方程式表示)。
来脱除烟气中的SO2 , 原理是、(用离子方程式表示)。
我国科学家研究了活性炭催化条件下煤气中的H2S和Hg的协同脱除,部分反应机理如图(吸附在催化剂表面的物种用*标注)。有关该过程的叙述错误的是( )

A . 产生清洁燃料H2
B . H2S 脱除率为100%
C . H2S既被氧化又被还原
D . 脱Hg反应为Hg+S= HgS
下列说法正确的是( )
A . 金属氧化物均为碱性氧化物
B . Na2CO3溶液遇酚酞变红,故Na2CO3是碱
C . BaSO4难溶于水,但BaSO4是电解质
D . 失电子数越多的物质还原性越强
某工厂以硝酸为原料生产亚硝酸钠,并对亚硝酸钠进行多角度探究。其工艺流程如下:

已知: ;
;
-
(1) 分解塔中填有大量的瓷环,其目的是:。分解塔中的温度不宜过高,其原因是:。
-
(2) 按一定计量比在分解塔中通
 和喷入硝酸,若反应后生成的
和喷入硝酸,若反应后生成的 与
与 物质的量之比恰好
物质的量之比恰好 , 则分解塔中发生反应的化学方程式为。
, 则分解塔中发生反应的化学方程式为。
-
(3) 下列关于吸收塔中变化,说法正确的是。
a.升高吸收塔的温度,有利于氮氧化物的吸收
b.加快通入吸收塔中气体的流速,有利于提高氮氧化物的利用率
c.可向尾气中通入一定量的
 , 再通入吸收塔中,实现循环吸收
, 再通入吸收塔中,实现循环吸收 -
(4) 酸性条件下
 具有还原性。取
具有还原性。取 样品,配成
样品,配成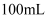 溶液。分别取出
溶液。分别取出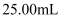 , 用
, 用 酸性标准溶液滴定三次,测得平均消耗
酸性标准溶液滴定三次,测得平均消耗 溶液。其离子方程式为:
溶液。其离子方程式为: 。计算样品中
。计算样品中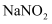 的纯度。(请写出计算过程)
的纯度。(请写出计算过程)
-
(5) 设计实验验证酸性条件下
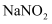 具有氧化性:取一定量
具有氧化性:取一定量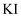 溶液,__。补充实验方案。(必须使用的试剂:
溶液,__。补充实验方案。(必须使用的试剂: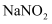 溶液、稀硫酸、淀粉溶液。)
溶液、稀硫酸、淀粉溶液。)
最近更新



