第二单元 硫及其化合物的相互转化 知识点题库
-
(1) 海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是.
-
(2)
利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去):
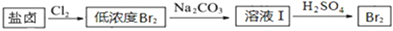
将Br2与Na2CO3反应的化学方程式补充完整:Br2+Na2CO3═NaBrO3++
-
(3)
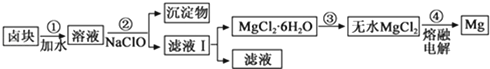
盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去):
生成氢氧化物沉淀的pH
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Fe(OH)2
7.6
9.6
Mn(OH)2
8.3
9.8
Mg(OH)2
9.6
11.1
①步骤②中需控制pH=9.8,其目的是.
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是.
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为.
④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClOg.
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变为蓝色.
下列判断正确的为( )
请你参与并协助他们完成相关学习任务.
该组同学的研究课题是:探究测定草酸晶体(H2C2O4•xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定.学习小组的同学设计了滴定的方法测定x值.
①称取2.520g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4 .
③用浓度为0.1000mol•L-1的KMnO4标准溶液进行滴定,达到终点时消耗20.00mL.
-
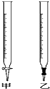
(1) 滴定时,将酸性KMnO4标准液装在如图中的(填“甲”或“乙”)滴定管中。
-
(2) 本实验滴定达到终点的标志是;
-
(3) 通过上述数据,求得x=;
讨论:①若滴定终点时仰视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同);
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会。
| 选项 | 目的 | 实验 |
| A | 除去溴苯中的溴 | 加蒸馏水后振荡、分液 |
| B | 验证SO2的漂白性 | 将SO2通入高锰酸钾溶液中 |
| C | 区分葡萄糖溶液和淀粉溶液 | 往两溶液中分别滴加KI溶液 |
| D | 比较浓H2SO4与浓HNO3的氧化性的强弱 | 常温下,将铜丝分别插入两溶液中 |
-
(1) 向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是,区别该液体和FeCl3溶液的方法是。
-
(2) 黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2
 Fe3O4+6SO2 , 氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
Fe3O4+6SO2 , 氧化产物为 ,若有3mol FeS2参加反应,转移 mol电子。
-
(3) 在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+ , 并有气体逸出,请配平该化学方程式:
FeSO4+KNO3+ H2SO4═ K2SO4+ Fe2(SO4)3+NO↑+ H2O。
-
(4) 铁红是一种红色颜料,其成分是Fe2O3 , 将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2 , 经检测,溶液中无Fe3+ , 则参加反应的铁粉的质量为 g。
-
(1) I.清代化学家徐寿创立了化学元素的中文名称和造字原则,推动了化学知识在中国的传播和应用。物质A由原子序数依次增大的短周期元素X、Y、Z组成,其中Z为金属元素,X、Y、Z简单离子的核外电子排布相同,物质A的结构式如图所示:

回答下列问题:
Y、Z元素的名称为徐寿确定并使用至今,Y在周期表中的位置是。
-
(2) 比较X、Y、Z简单离子的半径大小(用对应离子符号表示)。
-
(3) 在YZO2与YX的混合液中,通入足量CO2是工业制取A的一种方法,写出该反应的化学方程式。
-
(4) II.已知氰(CN)2、硫氰(SCN)2和(OCN)2、ICl、BrCl的性质与卤素单质相似,故称它们为拟卤素。回答下列问题。
写出硫氰(SCN)2的结构式。
-
(5) (CN)2和KOH溶液反应的化学方程式为:。
-
(6) 已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:。

①请配平偏二甲肼燃烧的化学方程式
C2H8N2 +N2O4  CO2 + H2O +N2
CO2 + H2O +N2
②氧化剂与还原剂的质量之比为。
 SO3
SO3  H2SO4
B . Si
H2SO4
B . Si  SiO2
SiO2  H2SiO3
C . NH3
H2SiO3
C . NH3 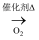 NO2
NO2  HNO3
D . Cl2
HNO3
D . Cl2  Br2
Br2  I2
I2

 溶液,均可产生白色沉淀
C . 图中由d转化为e需加入氧化剂
D . 将a与c混合,可生成淡黄色固体
溶液,均可产生白色沉淀
C . 图中由d转化为e需加入氧化剂
D . 将a与c混合,可生成淡黄色固体

资料:金属离子沉淀的pH
金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
-
(1) 写出酸浸前将菱锰矿石粉碎的目的是。
-
(2) 沉淀池1中,先加MnO2充分反应后再加氨水。写出加MnO2时发生反应的离子方程式:。
-
(3) 沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是。
-
(4) 如图为MnSO4和(NH4)2SO4的溶解度曲线。从“含MnSO4的溶液”中提取“MnSO4晶体”的操作为,洗涤干燥。

-
(5) 受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取10.0g废渣,加酸将锰元素全部溶出成Mn2+ , 过滤,将滤液定容于100mL容量瓶中。
ii.取25.00mL溶液于锥形瓶中,加入少量催化剂和过量(NH4)2S2O8(过氧硫酸铵)溶液,加热、充分反应后,煮沸溶液使过量的(NH4)2S2O8分解。
iii.加入指示剂,用bmol/L(NH4)2Fe(SO4)2溶液滴定。滴定至终点时消耗(NH4)2Fe(SO4)2溶液的体积为cmL,
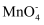 重新变成Mn2+。
重新变成Mn2+。①写出下面补全的步骤ⅱ中反应的离子方程式:。
2Mn2++
 + ▲ =
+ ▲ =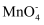 + ▲ + ▲ 。
+ ▲ + ▲ 。②废渣中锰元素的质量分数为。
-
(6) 废渣长期露置于空气,其中的锰元素逐渐转化为MnO2。研究者用如图装置提取MnO2中的锰元素。图中“H•”代表氢自由基。实验测得电解时间相同时,随外加电流的增大,溶液中的c(Mn2+)先增大后减小,减小的原因可能是。(任写一点)




