结晶的概念与方法 知识点题库
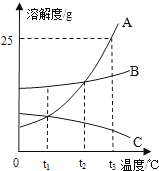
A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示。下列说法不正确的是 ( )

A . t1℃时,65克A的饱和溶液中含有50克溶剂
B . 将t2℃A、B、C三种物质的饱和溶液降温至t1℃,c溶液中溶质的质量分数保持不变
C . 在t2℃,A、B两种溶液中溶质的质量分数相同
D . 要从B溶液中得到B,通常可采用蒸发溶剂使其结晶的方法
A、B、C三种固体物质在水中的溶解度曲线如图所示,请回答:
(1) ℃时,A、B两种物质在100g水中达到饱和状态时溶解的质量相等;
(2)若B中混有少量的A,最好采用的方法提纯B;
(3)现有接近饱和的C物质溶液,使其变成饱和溶液的方法有:①加入C物质;②恒温蒸发溶剂;③;
(4)t3℃时将20g A物质放入50g水中,充分搅拌,所得溶液中溶质的质量分数是 ;
(5)将t3℃时等质量的A、B、C三种物质的饱和溶液降温至t1℃时,所得溶液的质量由大到小的顺序是 .
如图是甲、乙两种固体物质的溶解度曲线.下列说法错误的是( )

A . T℃时,甲、乙两物质的溶解度相等
B . 乙的饱和溶液降温时,溶质质量分数保持不变
C . 甲中混有少量乙,可采用降温结晶的方法提纯甲
D . T℃时,甲的饱和溶液溶质质量分数为20%
下列物质不属于结晶水合物的是( )
A . 食盐
B . 石碱
C . 胆矾
D . 明矾
卤水是从海水中提取食盐后的母液,常含有MgCl2、NaCl、MgSO4、KCl等,可进一步加工制得一些重要的产品.现按下列步骤对卤水进行处理,试根据有关物质的溶解度曲线(如图所示)回答下列问题:

-
(1) 将卤水加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体.这时得到的晶体的主要成分是.
-
(2) 过滤出上述晶体后,将滤液降温到30℃以下,还会逐渐析出晶体.这时得到的晶体的主要成分是.
-
(3) 将第(2)步操作得到的晶体用一定量的冷水洗涤,最后可以得到比较纯净的晶体.
如下表所示,为甲、乙两物质的溶解度表,请根据表格数据回答下列问题。

-
(1) 20℃ 时,将克甲固体物质加入到盛有100 克水的烧杯中,恰好完全溶解,得到饱和溶液;
-
(2) 根据表中数据,若要把溶解在乙溶液中的物质全部结晶出来,应采用法结晶;
-
(3) 乙溶液中含有泥沙(泥沙中的物质都不溶解),应采用方法获得乙溶液;
-
(4) 20℃时,将20克乙物质加入到50克水中,所形成的溶液质量分数为
从自然界中获得的粗盐,含有较多的杂质,需要精制。为了除去粗盐中泥沙等不溶性杂质需要溶解、过滤、蒸发结晶三个步骤。
-
(1) 溶解、过滤、蒸发结晶三个步骤的三个步骤中都用到了玻璃棒,在溶解和过滤中其作用分别是、。
-
(2) 在蒸发结晶步骤中,当蒸发皿内出现较多固体时,应该 (填字母)。A . 移去酒精灯,停止搅拌 B . 移去酒精灯,用玻璃棒继续搅拌 C . 继续加热蒸干水分,再移去酒精灯 D . 继续加热,停止搅拌
某温度下,硫酸铜热饱和溶液冷却到室温,观察到的现象是( )
A . 有蓝色晶体析出
B . 溶液变为无色
C . 溶液变为绿色
D . 有白色晶体析出
要使食盐从溶液中大量析出,最好的方法是( )
A . 冷却溶液
B . 蒸发溶剂
C . 加热溶液
D . 增大压强
硝酸钾的溶解度随温度升高而增大。如图是有关硝酸钾溶液的实验操作及变化情况。下列说法正确的是( )

A . 操作Ⅰ一定是降温
B . 操作Ⅰ一定是加溶质
C . ①与③的溶质质量一定相等
D . ②与③的溶质质量分数一定相等
死海因其高盐度出名,海里没有鱼虾、水草,甚至连海边也寸草不生。美国科学家对其十分好奇,乘船到死海,做了一个实验:(如图)他们将一件黑色礼服用钢丝固定,放入死海中,两年后取出,发现衣服表面挂满了白色盐晶。经检测,晶体中的成分主要包含氯化钠、氯化钙、氯化钾等。

-
(1) 鱼虾、水草等生物随河水到死海后会死亡的主要原因是;
-
(2) 黑色礼服上的白色盐晶,在这两年中经历的最主要过程是 ;A . 凝固 B . 蒸馏 C . 结晶 D . 升华
-
(3) 将衣服表面盐晶溶于水,加入饱和碳酸钠溶液,将出现 现象;
如图所示,将饱和硫酸铜溶液滴在凹穴玻片上,一段时间后观察是否有晶体析出。关于该实验,下列说法正确的是()

A . 实验所用的饱和硫酸铜溶液最好是常温下的溶液
B . 观察是否有晶体析出,可以用显微镜
C . 实验主要采用蒸发结晶的方法析出晶体
D . 滴到玻片上的溶液,一般需要10滴左右
将KNO3和K2SO4混合物进行分离,有如下操作:①将混合物溶解制成浓溶液;②加热蒸发浓溶液;③冷却溶液;④过滤,移出KNO3晶体;⑤过滤,移出K2SO4晶体。试据图分析,判断出正确的操作顺序是( )

A . ①②③④⑤
B . ①②⑤③④
C . ①③⑤②④
D . ①③④②⑤
宁波地处东南沿海,有着丰富的海洋资源,请思考下列问题:
-
(1) 已知宁波某盐场测得:①海水中含氯化钠约为3.5%;②在海边打深井,井水中含氯化钠约为8%。晒盐最好用(填序号)作原料。
-
(2) 关于晒盐原理的说法正确的是____。A . 利用阳光和风力,使水分蒸发,析出盐 B . 日光照晒后,氯化钠的溶解度变小
-
(3) 海水晒盐提取食盐晶体后留下的母液叫卤水,其中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)等物质可作为重要的化工原料,它们的溶解度曲线如图所示。

①40℃时,将50g硫酸镁加入100g水中,充分搅拌,所得溶液的溶质质量分数为(结果精确到0.1%)。若使其形成饱和溶液,可采取的措施有。
A.增加溶质 B.蒸发溶剂
C.升高温度 D.降低温度
②关于卤水中含有的氯化钾(KCl)、氯化镁(MgCl2)、硫酸镁(MgSO4)三种物质,下列说法正确的是。
A.三种物质均为易溶物质
B.10℃时,向40g氯化钾(KCl)固体和40g氯化镁(MgCl2)固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
C.60℃时,三种物质溶于水形成的溶液浓度可能相等
食盐是维持人体正常生理活动的重要物质,同时也是重要的化工原料。
-
(1) 小点同学用含杂质的食盐(杂质不溶于水)和蒸馏水配制150g 5%的氯化钠溶液,可能涉及以下过程及仪器:①称量,②过滤,③蒸发结晶,④计算,⑤溶解。

①正确的操作顺序是(填序号);除了用到铁架台、铁圈和上述提供的仪器外,还缺少的仪器是(填名称,一种即可)
②如果配制的溶液中NaCl的质量分数小于5%,则可能造成误差的实验操作原因有(选填字母序号)
A.溶解时将50g粗盐一次全部倒入水中,立即过滤
B.蒸发时,有一些液体、固体溅出
C.提纯后的精盐尚未完全干燥就称其质量
D.物品和砝码放错盘子
E.蒸发时食盐飞溅
F.采用俯视凹液面来量取水
小明用热开水配制了一杯饱和硝酸钾水溶液,溶液的温度是70℃,一个密度均匀的实心小球恰能悬浮在溶液中。在室温下放置一段时间后冷却到室温(溶液体积变化忽略不计),小球将 ( )
A . 上浮
B . 下沉
C . 悬浮
D . 无法确定
从自然界中获得的粗盐,含有较多的杂质,需要精制。为了除去粗盐中泥沙等不溶性杂质,设计了如图A、B、C三个步骤。

-
(1) B步骤称为。
-
(2) C步骤中,当蒸发皿内出现较多固体时,应该 (填字母)。A . 移去酒精灯,停止搅拌 B . 移去酒精灯,用玻璃棒继续搅拌 C . 继续加热蒸干水分,再移去酒精灯
氯化钠是生活必需品,也是重要的化工原料。提纯含少量泥沙的粗盐,一般经过如图操作流程。

-
(1) 操作③中需要将圆形滤纸折叠处理,下列图示中不该出现的情形是(填序号)。

-
(2) 操作④中除用到铁架台(带铁圈)、酒精灯、玻璃棒、坩埚钳外,还需要用到的仪器是,该操作中玻璃棒的作用是。
-
(3) 实验结束后称量获得精盐,发现精盐制得率较低,其可能原因是_______(填序号)。A . 食盐没有全部溶解即过滤 B . 蒸发时食盐飞溅剧烈 C . 蒸发后,所得精盐很潮湿 D . 器皿上沾有的精盐没全部转移到称量纸上
右图为 A 、B 两种固体物质的溶解度曲线, 请结合图形回答下列 问题。

-
(1) 交点C表示的意义是:在℃时,A、B两种物质的溶解度相等;
-
(2) 50℃时,A的饱和溶液中溶质与溶剂的质量比为;
-
(3) 如果在大量的A中含有少量杂质B,要提纯A,可先将样品配制成溶液,再采取(选填“蒸发溶剂”或“冷却热饱和溶液”)结晶的方法获得更高纯度的A。
红色经典影片《闪闪的红星》中有- 段儿童团员潘冬子给红军送盐的故事。冬子开始把食盐装在竹简中,打算扮作上山砍柴的人将食盐送给红军。途中发现敌人盘查严格,冬子急中生智跑到河边,把竹简里的食盐全部格成盐水,再用棉袄吸收,最终顺利地将食盐送给了红军。

-
(1) 从盐水中重新得到食盐固体,需进行操作的名称。
-
(2) 氯化钠的溶解度曲线如图。假设冬子的竹简中有358g氯化钠,10℃时最少需用g水溶解。
-
(3) 从微观角度分析,氯化钠是由(填“分子”“原子”或“离子”)构成。
最近更新



