结晶的概念与方法 知识点题库
右图所示是a、b、c(不含结晶水)三种固体物质的溶解度曲线,下列说法正确的是( )
现有一瓶混有少量氯化钾的硝酸钾粉末,请参照如图KCl和KNO3的溶解度曲线,回答下列问题:
(1)t℃时KCl的溶解度 KNO3的溶解度(填“大于”“小于”或“等于”).
(2)60℃时 gKNO3溶于50g水中恰好形成饱和溶液.
(3)设计实验方案提纯KNO3 .
实验方案:在提纯混有少量氯化钾的硝酸钾时,先在较高温下将混合物溶于水中形成热的浓溶液,然后 ,即有大量硝酸钾晶体析出,再进行 操作,即可分离得到较为纯净的硝酸钾晶体.

运用溶解度表与溶解度曲线回答下列问题:
温度/℃ | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 |
(1)氯化钠的溶解度曲线是 (填“A”或“B”).
(2)60℃时,100g水中加入90g硝酸钾,充分溶解,所得溶液是 (填“饱和”或“不饱和”)溶液.当60℃的该溶液降温到10℃时,析出晶体的质量为 g.

如图是A、B、C三种固体(都不含结晶水)物质的溶解度曲线.下列说法或判断中正确的是( )

如图是甲乙两种固体物质(均不含结晶水)的溶解度曲线,请你根据曲线回答一下问题.
(1)50℃时,60g的甲物质加入到100g水中充分溶解,最终形成溶液的质量为 g.
(2)30℃时,甲的饱和溶液比乙的饱和溶液溶质质量分数(填“大”、“小”或“相等”).
(3)50℃时,等质量的甲、乙饱和溶液降温到20℃,析出晶体多的是(填“甲”或“乙”).

含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途.
Ⅰ.以含锌废渣(主要成分为ZnO,杂质为FeO、CuO)为原料制备七水硫酸锌(ZnSO4•7H2O)的流程如图1.

-
(1) 粉碎的目的是 .
-
(2) 若实验室用质量分数为98%的硫酸配制200g 25%的硫酸,需要的玻璃仪器有胶头滴管、玻璃棒、和 , 此处玻璃棒的作用是 .
-
(3) 物质X是 , 滤渣中含有金属单质有 , 除铜时发生的反应属于反应(填基本反应类型)
-
(4) 流程中获得七水硫酸锌前省略的操作是、冷却结晶、、洗涤和低温烘干.
-
(5) 某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化学式是 .
-
(6) 除铁过程中,温度、pH对除铁效果的影响分别如图2所示.由图可知,除铁时温度应控制在 ℃为宜,pH应控制在 为宜.
-
(7)
以某菱锌矿(ZnCO3含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
ZnCO3
 ZnO+CO2↑ ZnO+CO
ZnO+CO2↑ ZnO+CO Zn+CO2 .
Zn+CO2 . 则100吨这样的菱锌矿理论上最多可制得锌多少吨?(写出计算过程)
如图为几种固体的溶解度曲线,回答下列问题:
(1)NaCl的溶解度随温度变化的规律是 .
(2)30℃时,KNO3溶液的最大浓度(溶质质量分数)为 (只列计算式,不需要计算结果).
(3)60℃时,10g NaCl和90g KNO3完全溶解于100g蒸馏水,冷却到30℃后,(“有”或“没有”)NaCl析出,有 g KNO3结晶析出.

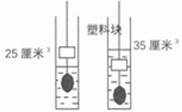 B . 物体变到水的浮力为1牛
B . 物体变到水的浮力为1牛  C . 蒸发食盐水
C . 蒸发食盐水 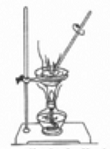 D . 熄灭酒精灯
D . 熄灭酒精灯 
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
|
溶解 度/g |
氯化钠 |
35.7 |
35.8 |
36.0 |
36.6 |
37.3 |
38.4 |
|
纯碱 |
7.1 |
12.5 |
21.5 |
38.8 |
46.0 |
43.9 |
|
-
(1) 由溶解表可知,氯化钠与纯碱的溶解度恰好相等时的温度范围是_____________A . 0℃~10℃ B . 10℃~20℃ C . 20℃~ 40℃ D . 40℃~60℃
-
(2) 长期在液面以外的咸菜表面会出现白色晶体,这晶体的形成与(填“冬天捞碱”或“夏天晒盐”)的原理一致。
-
(3) 生活中纯碱既可用于洗衣又能发面。现要配制纯碱溶液,取48克纯碱溶于100克60℃的水中,所得溶液的溶质质量分数为多少(保留一位小数)?
-
(1) 碘酒是医院常用的消毒药品,碘酒中的溶剂是。
-
(2) 用海水晒盐:从海水中提取获得食盐氯化钠,通常采用的方法是。
-
(3) 打开汽水的瓶盖后往往有大量的气泡冒出,这说明了气体溶解度与有关;喝了汽水会打嗝,说明气体的溶解度还与有关。
| 温度/℃ | 5 | 10 | 15 | 20 | 25 |
| 溶解度/g | 130 | 140 | 160 | 190 | 220 |
|
温度/℃ |
20 |
30 |
40 |
50 |
60 |
|
|
溶解度/g |
氯化钠 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
|
硝酸钾 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
-
(1) 要把硝酸钾从含有少量氯化钠的溶液中提出,最好釆用的方法是。提纯含少量泥沙的粗盐,一般经过以下操作流程:

-
(2) 在做过滤实验后,发现得到的滤液仍然浑浊,其可能的原因是(写出一种)
-
(3) 操作⑤的名称是,玻璃棒的作用是。
-
(4) 实验结束后称量获得的精盐,发现精盐含量较低,其可能原因是 (可多选)。A . 食盐没有全部溶解即过滤 B . 蒸发时食盐飞溅剧烈 C . 蒸发后,所得精盐有点潮湿 D . 器皿上沾有的精盐没全部转移到称量纸上
-
(1) A组实验有:①过滤含泥沙的食盐水;②蒸发氯化钠溶液获得晶体;③测某种盐水的密度。甲同学抽到的是A组中的一个实验,需要的器材如图甲所示:

则他抽到的实验是选填序号)。
-
(2) 乙同学抽到了如图乙的实验,在她的实验中,玻璃棒的作用是,实验结束时,她发现滤液是浑浊的,导致这种现象的原因可能是。
-
(3) 丙同学抽到的是B组中的一个实验:配制50克10%的氯化钠溶液。丙同学若用的是提纯后的精盐进行实验,那么下列哪些原因会导致所得溶液的质量分数偏小 (可多选)。A . 提纯后所得的精盐不纯净,仍然含有可溶性的杂质 B . 量筒量取水时仰视读数 C . 溶液配制好后装入试剂瓶时有部分洒到桌面上 D . 天平称取精盐时左物右码颠倒
a.食盐和沙 (填数字序号,下同);b.从海水中获取食盐。
| 温度/℃ 溶解度/g |
0 |
20 |
40 |
60 |
80 |
100 |
| 氯化钠 |
35.7 |
36 |
36.6 |
37.3 |
38.4 |
39.8 |
| 硝酸钾 |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
-
(1) 从氯化钠溶液中得到氯化钠固体应采用的方法是。
-
(2) 20℃时,向100g水中加入50g硝酸钾,充分溶解后形成的溶液是硝酸钾的 (填“饱和”或“不饱和”)溶液。再将温度升高到60℃时,溶液的质量为克。



