身边的化学物质 知识点题库
酸、碱、盐是生活中常见物质,它们之间会发生各种反应。
-
(1) 俗称小苏打的物质是____A . 氢氧化钠 B . 碳酸钠 C . 碳酸氢钠 D . 氯化钠
-
(2) 实验室制取气体常会用到氧化物、酸、碱、盐。

①利用上述仪器可以实验室制取二氧化碳,你选择的仪器是(填序号),反应原理是(用化学方程式表示)。
②同学们用如图所示装置继续探究二氧化碳的某些性质,能证明二氧化碳能与水反应的现象是;若石灰水不出现浑浊现象,可能原因是。

③如果用氯酸钾和二氧化锰制取氧气,还需补充的玻璃仪器的名称是;若用如图用排空气法收集氧气,气体从b导管口通入,这是利用的氧气的性质。

-
(3) 某同学用氯酸钾和二氧化锰的混合物制取氧气,他将32.5g固体混合物加热,完全反应后冷却,称得剩余固体为22.9g,求原混合物中氯酸钾的质量。
欲测定一瓶丢失标签的稀硫酸的溶质质量分数,现取 20g 该稀硫酸样品于烧杯中,将溶质质量分数为 10%的 NaOH 溶液逐滴滴入到烧杯中,边滴边搅拌,用 pH 传感器测得溶液 pH 与加入 NaOH 溶液的关系曲线如图所示。

请回答下列问题:。
-
(1) 图中 A 点溶液中包含的微观粒子有(填化学符号)
-
(2) 计算该稀硫酸的溶质质量分数。(写出计算过程,精确到 0.1%)
用沉淀法测定食用碱样品(含少量氯化钠杂质)中碳酸钠的质量分数。取10g样品加90g水完全溶解制成溶液,逐次滴加溶质质量分数相同的氯化钙溶液,(化学方程式: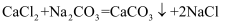 )实验数据如下表:
)实验数据如下表:
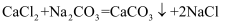 )实验数据如下表:
)实验数据如下表:实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入CaCl2溶液的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
反应后溶液的总质量/g | 118.0 | 136.0 | M | 172.0 | 192.0 |
请根据实验数据分析解答下列问题:
-
(1) 表中数据M的值为。
-
(2) 第次恰好完全反应。
-
(3) 该样品中碳酸钠的质量分数是多少?
A~E是初中化学常见物质,它们的关系如图所示(“→”表示一步生成,“—“表示可以反应),其中A、B、E加入水中所得溶液能使酚酞溶液变红,且三者属于不同类别的化合物,B、D均为氧化物,C的相对分子质量为100。请回答:

-
(1) B的化学式为 。
-
(2) E的俗名为。
-
(3) C→D的化学方程式为。
氢化钙(CaH2)能与水反应生成氢气和一种碱,下列有关该反应的说法错误的是( )
A . 该反应不属于置换反应
B . 生成的碱的化学式是Ca(OH)2
C . 参加反应的氢化钙和水的质量比为7:6
D . 氢化钙中氢元素的化合价为+1
化学与生活息息相关。请结合所学知识回答下列问题。
-
(1) 炒菜时,油锅里的油着火,可以用锅盖盖灭,灭火原理是什么?。
-
(2) 从分子的角度解释“墙内开花墙外香”。。
2022年2月4日,北京冬奥会火炬首次采用“绿氢”作为火炬燃料,其储存采用了高压储气的方式。下列关于该储气过程的说法正确的是( )

A . 氢分子的体积变小
B . 氢分子的质量变小
C . 氢分子的数目变少
D . 氢分子间的间隔变小
2021 年“天问一号”探测器成功着陆火星,采用了我国自主研发的新型镁锂合金材料。结合图示,下列说法错误的是( )

A . 镁锂合金属于金属材料
B . 锂的原子质量是 6.941 g
C . 镁原子的核外电子数为 12
D . 镁锂合金硬度比其纯金属的硬度大
-
(1) I、用如图一装置进行气体的制取及其性质实验(夹持仪器略去)。
甲中发生反应的化学方程式是。
-
(2) 乙中氧气的收集方法是;乙中的实验现象是。
-
(3) 用注射器代替长颈漏斗的优点是。

-
(4) Ⅱ、兴趣小组设计了如图二所示装置(夹持仪器已略去)做了2个趣味实验。实验时,打开止水夹,C瓶内的水流入D中,使B试管内气压减小,B中长导管口有气泡冒出。
在A处烧杯内放置燃烧的蜡烛,打开止水夹,B中无色溶液变浑浊,B中的试剂是。
-
(5) 在A处烧杯内放置某溶液,打开止水夹。若B中盛有紫色石蕊溶液,石蕊溶液变红色;若B中盛有红色溶液,红色溶液变无色,则A处烧杯内的溶液是,B中红色溶液可能是。
请阅读下列材料,完成下面小题:
以NaCl、NH3、CO2等为原朴,通过反应  可制得小苏打。海水是获取NaCl的重要来源之一,每1000g水中所含NaCl、MgCl2的质量分别约为26.7g、3.3g。以海水为原料生产NaCl晶体的主要过程如下:
可制得小苏打。海水是获取NaCl的重要来源之一,每1000g水中所含NaCl、MgCl2的质量分别约为26.7g、3.3g。以海水为原料生产NaCl晶体的主要过程如下:

-
(1) 下列有物质的性质与用途具有对应关系的是( )A . NaCl有咸味,可用作融雪剂 B . CO2能与水反应,可用作制冷剂 C . NaHCO3能与酸反应,可用作抗酸药物 D . NH4Cl易溶于水,可用作氮肥
-
(2) 已知NaCl、MgCl2的部分溶解度数据如下表。下列关于海水制盐的说法中正确的是( )
温度
0℃
10℃
20℃
30℃
40℃
NaCl的溶解度/g
35.7
35.8
36.0
36.3
36.6
MgCl2的溶解度/g
52.9
53.6
54.6
55.8
57.5
A . 20℃时,NaCl饱和溶液中溶质的质量分数约为36% B . “晒盐”的过程中,NaCl和MgCl2的溶解度不断减小 C . 20℃时,当海水中水量蒸发掉95%时,MgCl2可能会结晶析出 D . “洗盐”过程中,固体中NaCl的质量基本保持不变
强化安全意识,提升安全素养。下列说法正确的是( )
A . 炒菜时油锅着火,立即用水浇灭
B . 进入地窖前,要先进行灯火实验
C . 用大量水灭火是为了降低可燃物的着火点
D . 加油站、面粉厂都应粘贴如图的警示图标 

生活中用含有碘酸钾(KIO3)的食盐预防甲状腺肿大,KIO3中碘的化合价为( )
A . +1
B . +3
C . +5
D . +7
为除去粗盐样品中的MgSO4和CaCl2杂质,获得氯化钠溶液,设计了如图所示的流程。

请回答下列问题。
-
(1) 操作Ⅱ用到的玻璃仪器有烧杯、玻璃棒和。
-
(2) 请写出加入的Y溶液中溶质的化学式。
-
(3) 写出加入稀盐酸时发生中和反应的化学方程式。
甲、乙两种物质溶解度曲线如图所示。下列说法正确的是( )

A . a1℃时,甲、乙的溶解度相同
B . 甲的溶解度受温度影响比乙小
C . 当甲中混有少量乙时,可采用蒸发的方法提纯甲
D . a2℃时,在100g水中加入30g甲,形成饱和溶液
端午节有吃粽子的习俗,“粽子香,香厨房,艾叶香,香满堂”。“香厨房”、“香满堂”主要体现分子具有的性质是( )
A . 分子不断运动
B . 分子可以再分
C . 分子有香味
D . 分子间有间隔
下列有关溶液的形成,表述正确的是( )
A . 溶液不一定是无色的
B . 被溶解的物质称作溶剂
C . 只有固体和液体能做溶质
D . 碘放在水里会形成碘的水溶液
如图所示,某兴趣小组用三枚洁净无锈铁钉探究铁生锈的条件。

-
(1) 四天后,(填字母序号)试管中铁钉有明显锈迹。
-
(2) 由此实验可以得出铁生锈的条件是。
Fe3O4的化学名称是( )
A . 三铁化四氧
B . 氧四化铁三
C . 四氧化三铁
D . 铁三化氧四
A~J是初中化学常见的物质,且分别是由C、H、O、N、Na、S、Fe、Cl中的一种或几种元素组成。I为单质,A、B、F、G、J均由两种元素组成,其中A、F、J为氧化物且A为红棕色固体,其余物质均由三种元素组成。D物质俗称为烧碱,物质H可作氮肥。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。

-
(1) 写出化学式:D,I。
-
(2) 写出H→G反应的化学方程式。
-
(3) 写出A与B反应的化学方程式。
-
(4) C→I反应的基本反应类型为。
选择下列适当的物质填空(选填序号):
A.氢气 B.聚乙烯 C.石灰石 D.聚氯乙烯 E.蛋白质 F.纤维素 G.食盐 H.熟石灰
-
(1) 用于工业生产烧碱的是。
-
(2) 鸡蛋清中富含的营养物质。
-
(3) 可用于改良酸性土壤的是。
-
(4) 工业炼铁的原料是。
-
(5) 未来最理想的能源的是。
-
(6) 用于食品包装袋的是。
最近更新



