晶体和结晶的概念与现象 知识点题库
KCl的部分溶解度数值如表,下列说法正确的是( )
温度 | 溶解度(g) |
20℃ | 34 |
30℃ | 37 |
A . 常温下,KCl微溶于水
B . 20℃时,100g饱和溶液含有34g溶质
C . 将30℃的饱和KCl溶液降温至20℃,会有KCl晶体析出
D . 相同质量的水中加入不同质量的KCl,所得溶液的溶质质量分数一定不同
下列关于溶液的说法中,正确的是( )
A . 接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态
B . 某溶液降低温度后能析出晶体,则原溶液一定是饱和溶液
C . 当饱和溶液析出晶体后,剩余溶液中溶质的质量分数一定减少
D . 用100g溶质质量分数为10%的NaCl溶液配制溶质质量分数为20%的NaCl溶液需要蒸发水45g
t2℃时,将等质量的a、b两种可溶性固体分别加入盛有相同质量水的烧杯中,充分搅拌后的现象如图1所示,a、b两种物质的溶解度曲线如图2所示.请结合图示回答下列问题:

-
(1) 图1中,(填“a”或“b“)物质的溶解一定达到了饱和状态.
-
(2) 图2中,(填“甲”或“乙”)表示a的溶解度曲线.
-
(3) 将图1中a溶液的温度从t2℃降低到t1℃,所得溶液与原溶液相比较,通常没有发生变化的是 (填序号).A . 溶液的浓度 B . 溶剂的质量 C . 溶解度
-
(4) t2℃时a、b两物质的饱和溶液分别蒸发等量的水后再恢复到t2℃,析出晶体质量较多的是.
回答下列问题:
-
(1) 判断下列化学符号中“2”的含义,并用相应的序号填空.
a.表示微粒数目 b.表示元素化合价 c.表示离子所带电荷数
①2NH3:;②CO32﹣:;③
 O:;
O:; -
(2) 选择合适的化学术语,并用相应的序号填空.
a.氧化 b.吸附 c.结晶
①活性炭能冰箱内的异味;②水果在空气中因而腐烂;
③冬天,蜂蜜中会出现白色固体,是因为低温时蜂蜜中的葡萄糖.
把盛有饱和硝酸钾溶液(内含少量未溶解的KNO3晶体)的试管与一根U形管连通,U形管内盛有水,并将试管插在盛水的烧杯中(如图所示)。如果往烧杯中缓慢加入浓硫酸,此时试管内的KNO3溶液的质量以及U形管中液面变化分别是( )

A . 减少、左高右低
B . 增加、左高右低
C . 减少、左低右高
D . 增加、左低右高
根据下表回答问题。
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度(g) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
-
(1) 20℃时,溶解度最大的物质是;
-
(2) 50℃时,在100g水中放入36g氯化钠充分溶解,待温度降到40℃,得到的是氯化钠的溶液(选填“饱和”或“不饱和”);
-
(3) 现将100gKNO3和38gNaCl同时放入一个盛有100克80℃水的烧杯中,然后降温至20℃,析出固体的质量为克。
溶液与人们的生活息息相关。
-
(1) 氯化钠、硝酸钾、氢氧化钙在不同温度时的溶解度如下表所示:
温度/℃
0
20
40
60
80
100
溶解度/g
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾
13.3
31.6
63.9
110
169
246
氢氧化钙
0.19
0.17
0.14
0.12
0.09
0.08
①60℃时,氯化钠的溶解度硝酸钾的溶解度(填“>”、“<”或“=”)。
②氢氧化钙的饱和溶液加热后变浑浊,原因是。
③20℃时,向氢氧化钙的饱和溶液中加入少量生石灰并恢复至20℃,溶液中溶质的质量
(填“增大”、“减小”或“不变”)。
④要从含有少量氯化钠的硝酸钾溶液中得到较多的硝酸钾,可以采用加热浓缩、、过滤的方法,得到的滤液中含有(填离子符号)。
-
(2) 制作“叶脉书签”需要使用质量分数为10%的氢氧化钠溶液。用氢氧化钠固体配制50g质量分数为10%的氢氧化钠溶液,配制过程如下图所示:

①写出图中标号仪器的名称:a。
②指出图中称量步骤的错误操作:
;。
③若用质量分数为25%的氢氧化钠溶液配制50g质量分数为10%的氢氧化钠溶液,所需25%的氢氧化钠溶液和水的质量比为。
小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见表)。通过分析他得出以下结论,其中错误的是( )
| 20℃ | 40℃ | |
| 水 | 109g | 129g |
| 酒精 | 17.3g | 40g |
A . 温度和溶剂种类对NaOH的溶解度都有影响
B . NaOH易溶于水,也易溶于酒精
C . 40℃,40gNaOH溶解在l00g酒精中达到饱和
D . 将等质量40℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20℃,析出的晶体前者比后者多
甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。下列说法正确的是( )

A . t1℃时,甲、乙两物质的饱和溶液中溶质的质量分数相等,且都等于 60%
B . t2℃时,甲、乙两种物质的饱和溶液,降温至t1℃,析出晶体质量,甲不一定大于乙
C . t1℃时,将甲、乙两种物质的饱和溶液升温至t2℃时,溶质的质量分数甲大于乙
D . t1℃时,将甲、乙两种物质的饱和溶液分别降温到0℃,乙析出晶 体比甲析出晶体多
图1是甲、乙、丙三种固体物质的溶解度曲线,图2是30℃时,取其中两种固体各1g分别放进盛有10g水的两支试管中,充分振荡后的溶解情况,下列说法正确的是( )

A . 甲物质的溶解度比乙物质的溶解度大
B . 加入试管1的固体是丙
C . 向烧杯中加入NH4NO3固体后,试管2中一定有晶体析出
D . 将30℃时甲、乙、丙三种物质的饱和溶液各100g降温至20℃,所得溶液中溶质的质量分数的大小关系是乙>甲>丙
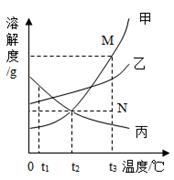
如图是甲、乙、丙三种固体物质的溶解度曲线,且它们溶于水时溶液温度均无明显变化.回答下列问题:
-
(1) 丙物质的溶解度随温度升高为(填“增大”或“减小”)
-
(2) t1℃时,三种物质的溶解度大小顺序为.
-
(3) t2℃时,等质量的甲、乙两种物质的饱和溶液中溶剂的质量大小关系为甲乙(填“>”、“<”或“=”).
-
(4) 若甲物质中混有少量的丙物质,可采用的方法提纯甲.
-
(5) 若要将组成N点的甲溶液转变为M点的甲溶液,可以采用的方法是__.
分析图中KNO3、NaCl两种固体的溶解度曲线,回答下列问题。

-
(1) 在35℃时NaCl的溶解度(选填“大于”“等于”“小于”)KNO3的溶解度。
-
(2) 20℃时将25gKNO3放入100g水中充分搅拌,得到该溶液的质量为g。
-
(3) 10℃时将10gNaCl和30gKNO3加入到100g的水中,充分搅拌。发现有固体剩余,则剩余的固体是(不考虑两物质对溶解性的影响);
-
(4) 硝酸钾溶液中混有的少量氯化钠,提纯硝酸钾可采取(选填“降温结晶” 或“蒸发结晶”)。
如图是甲、乙两种固体物质的溶解度曲线,下 列说法正确的是( )

A . t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B . t2℃时,甲、乙溶液中溶质的质量分数相等
C . t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D . 将t3℃时甲、乙的饱和溶液降温至t1℃,甲固体析出的质量比乙大
根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )

A . 无法判断a中溶液是否为饱和溶液
B . b中溶液在加热至c的过程中始终为饱和溶液
C . c中溶液溶质的质量分数为33.3%
D . 用冷却热的饱和溶液的方法获得氯化钠晶体
NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是( )
| 温度/℃ | 0 | 20 | 40 | 60 |
| NaCl的溶解度/g | 35.7 | 36.0 | 36.6 | 37.3 |
| KNO3的溶解度/g | 13.3 | 31.6 | 63.9 | 110 |
A . 20℃时,100gH2O最多能溶解36.0gNaCl
B . 40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C . 可用冷却海水的方法获取大量食盐
D . 其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
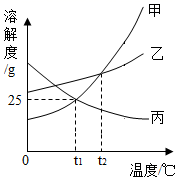
甲、乙、丙三种固体物质的溶解度曲线如图所示。
-
(1) ℃时,甲、乙两种物质的溶解度相等。
-
(2) 甲中含有少量的乙,可采用方法提纯甲。
-
(3) t2℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的顺序是。
-
(4) t1℃时,将15g甲物质加入到50g水中充分溶解后,所得溶液中溶质的质量分数为。
NaCl和KNO3的溶解度曲线如右图所示。下列说法正确的是( )

A . KNO3的溶解度一定大于NaCl
B . NaCl的溶解度受温度影响的程度比KNO3大
C . 40℃时,KNO3饱和溶液的溶质质量分数为63.9%
D . 将60℃时210g KNO3饱和溶液降温至20℃,析出KNO3晶体78.4g
甲、乙、丙三种固体物质的溶解度曲线如下图所示,请回答下列问题:

-
(1) t1℃时,丙物质的溶解度为g。
-
(2) t2℃时,往盛有50g蒸馏水的烧杯中加入50g甲固体,充分溶解后所得溶液的质量为g。
-
(3) 除去甲中含有的少量丙,可采用的方法是法(填“降温结晶”或“蒸发结晶”)。
-
(4) 将t1℃时的甲、乙、丙三种物质的饱和溶液升温至t2℃,所得溶液溶质的质量分数由大到小的顺序为。
氯化钠是食盐的主要成分。电影《闪闪红星》讲述了潘东子给山上红军送盐的故事。
-
(1) 藏盐:潘东子将食盐水吸在棉衣内给红军送盐。每人每天约需3—5g食盐,假设潘东子的棉衣可吸1000g水配成的食盐水,则3℃时潘东子上山一次所携带的食盐,最多可以满足名红军战士一天所需(3℃时,氯化钠的溶解度约为35.7g)。
-
(2) 取盐:为取出食盐,潘东子将吸有食盐的棉衣放进水里,揉一揉,搓一提,其目的是。然后,把得到的“水”倒进锅里煮干,这种获得食盐的方法是。
甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示。下列说法错误的是( )

A . t2℃时,甲、乙的溶解度相等
B . t1℃时,甲的饱和溶液中溶质与溶剂的质量之比为1:5
C . t3℃时,分别将甲、乙固体溶于水,配成两种物质的饱和溶液各100g,所需甲的质量小于乙的质量
D . 甲中含有少量的乙,可采用冷却热的饱和溶液的方法提纯甲
最近更新



