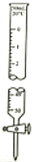铜的电解精炼 知识点题库
关于下列各装置图的叙述中,正确的是( )

A . 若采用装置①精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
B . 装置②是原电池,能将化学能转化为电能,锌电极发生还原反应
C . 装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D . 装置④可用于收集氨气,并吸收多余的氨气
下列说法正确的是( )
A . 电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等
B . 合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
C . 对于△H<0,△S>0的反应,不仅能自发进行,反应速率也很快
D . S(g)+O2(g)=SO2(g)△H1 , S(s)+O2(g)=SO2(g)△H2;则△H1<△H2
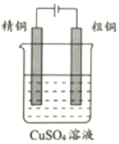
以硫酸铜溶液作电解液,对含有杂质Fe、Zn、Ag的粗铜进行电解精炼.下列叙述正确的是( )
①粗铜与直流电源负极相连
②阴极发生的反应为Cu2++2e﹣=Cu
③电路中每通过3.01×1023个电子,得到的精铜质量为16g
④杂质Ag以Ag2SO4的形式沉入电解槽形成“阳极泥”
A . ②③
B . ②④
C . ③④
D . ①③
下列叙述中正确的是( )
A . 电解饱和食盐水可以得到金属钠
B . 电解法精炼粗铜,粗铜作阳极
C . 在铁制品上镀上一定厚度的锌层,可用锌做阴极,铁制品做阳极
D . 用惰性电极电解Na2SO4溶液,一段时间后再加入硫酸,能使溶液恢复到电解前的状态
下列说法正确的是( )
A . 根据反应Cu+H2SO4  CuSO4+H2↑可推出Cu的还原性比H2的强
B . 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C . 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D . 由置换反应I2+2NaClO3=2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
CuSO4+H2↑可推出Cu的还原性比H2的强
B . 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C . 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D . 由置换反应I2+2NaClO3=2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
 CuSO4+H2↑可推出Cu的还原性比H2的强
B . 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C . 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D . 由置换反应I2+2NaClO3=2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
CuSO4+H2↑可推出Cu的还原性比H2的强
B . 电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次序依次是Cu2+、H+、Pb2+
C . 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体(不考虑SO2在水中的溶解)
D . 由置换反应I2+2NaClO3=2NaIO3+Cl2可知I2的氧化性强于Cl2的氧化性
下列化学用语表示正确的是( )
A . 羟基的电子式: 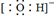 B . 甘氨酸的结构简式:C2H5NO2
C . AlCl3溶液中Al3+水解的离子方程式:Al3++3H2O
B . 甘氨酸的结构简式:C2H5NO2
C . AlCl3溶液中Al3+水解的离子方程式:Al3++3H2O  Al(OH)3+3H+
D . 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
Al(OH)3+3H+
D . 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
 Al(OH)3+3H+
D . 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
Al(OH)3+3H+
D . 粗铜(含Cu及少量Zn、Fe、Ag等)电解精炼时,阳极主要发生反应:Ag-e-=Ag+
下列说法正确的是( )
A . 电解精炼铜时,粗铜跟电源的正极相连
B . 用石墨做电极电解饱和食盐水时,阴极产生黄绿色气体
C . 构成原电池的正极和负极必须是两种不同金属
D . 原电池是把化学能转变为电能的装置
用石墨电极电解氯化铜溶液,装置如图。请回答下列问题:

-
(1) 阳极上的气体颜色为; 该装置工作过程中的能量转化方式为。
-
(2) 写出电解初期阴极的电极反应式。
-
(3) 电解一段时间后取出阴极的石墨棒,发现表面有浅蓝色固体Cu(OH)2 , 请说明Cu(OH)2产生的原因。
NA表示阿伏加德罗常数的值。下列判断正确的是( )
A . 1mol C3H8分子中含共用电子对数为10NA
B . 1mol Cl2参加反应,转移电子数一定为2NA
C . Na2S和Na2O2固体混合物7.8克中,含有的阴离子数为0.3 NA
D . 电解精炼铜时,阳极质量减少12.8g时,转移电子数为0.4NA
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语正确的是( )
A . 以硫酸作电解质溶液的氢氧燃料电池的负极反应式为O2+2H2O+4e-=4OH-
B . 铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(s)-2e-+2H2O(l)=PbO2(s)+4H+(aq)+SO42-(aq)
C . 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为Cu-2e-=Cu2+
D . 用铁电极电解饱和食盐水2Cl-+2H2O  Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )
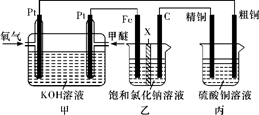
A . 通入甲醚的一极为负极,发生的电极反应为:CH3OCH3-12e-+16OH- =2CO32-+11H2O
B . 乙装置中铁电极为阴极,电极反应式为Fe-2e-= Fe2+
C . 反应一段时间后,乙装置中生成的氢氧化钠在石墨极区
D . 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
下列描述中,不符合生产实际的是( )
A . 电解熔融的氧化铝制取金属铝
B . 电解法精炼粗铜,用粗铜作阴极
C . 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D . 在镀件上电镀锌,用锌作阳极
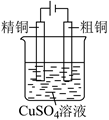
利用电解法可将含有  等杂质的粗铜提纯。下列叙述中正确的是( )
等杂质的粗铜提纯。下列叙述中正确的是( )
 等杂质的粗铜提纯。下列叙述中正确的是( )
等杂质的粗铜提纯。下列叙述中正确的是( )
A . 电解时精铜作阳极
B . 粗铜连接电源的负极
C . 电解时阴极上发生的电极反应为  D . 电解后,电解槽底部会形成含有少量
D . 电解后,电解槽底部会形成含有少量  等金属的阳极泥
等金属的阳极泥
 D . 电解后,电解槽底部会形成含有少量
D . 电解后,电解槽底部会形成含有少量  等金属的阳极泥
等金属的阳极泥
电解原理在化学工业中有着广泛的应用。如图所示装置,E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。下列说法中错误的是( )

A . 用甲装置精炼铜时,C电极材料为精铜
B . 乙装置中E电极反应为:4OH--4e-=O2↑+2H2O
C . 用丙装置给铜件镀银,当乙中溶液的OH-浓度是0.1mol·L-1时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为5.4g
D . 电解一段时间后,发现丁中Y极附近溶液红褐色加深,则Fe(OH)3胶粒带正电荷
下列对于电化学说法正确的是( )
A . 为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
B . 电解精炼铜时,阳极泥中常含有金属金、银、锌等
C . 可充电电池放电时,化学能转变为电能
D . 利用电解池原理对金属进行腐蚀防护的方法叫牺牲阳极的阴极保护法
某小组用如图装置模拟电镀铜和精炼铜。下列说法错误的是( )

A . 电镀铜和精炼铜时,Y上的电极反应都是:Cu2++2e-=Cu
B . 电镀铜时,Y 电极为待镀的金属制品
C . 精炼铜时,X 电极是粗铜,比铜活泼的金属最终变成阳极泥
D . 电镀铜时,X 电极是铜,溶液中的Cu2+浓度保持不变
下列实验装置设计与对应结论正确的是( )
| | | | |
| A.X若为苯,可用于吸收 | B.制取 | C.验证铁发生吸氧腐蚀 | D.电解精炼铜 |
A . A
B . B
C . C
D . D
以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法错误的是( )
A . 粗铜接电源正极,发生氧化反应
B . 溶液中Cu2+向阴极移动
C . 电解过程中,阳极和阴极的质量变化可能不同
D . 利用阳极泥可回收Al、Zn等金属
下列化学用语对事实的表述错误的是( )
A . 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH 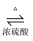 C17H35COOC2H5+H218O
B . 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
C17H35COOC2H5+H218O
B . 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O  NH4++OH−
C . 由Na和Cl形成离子键的过程:
NH4++OH−
C . 由Na和Cl形成离子键的过程:  D . 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
D . 电解精炼铜的阴极反应:Cu2+ +2e−=Cu
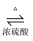 C17H35COOC2H5+H218O
B . 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
C17H35COOC2H5+H218O
B . 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O  NH4++OH−
C . 由Na和Cl形成离子键的过程:
NH4++OH−
C . 由Na和Cl形成离子键的过程:
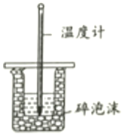
下列实验装置或操作能达到实验目的的是( )
选项 | A | B | C | D |
目的 | 准确量取25.00mLNaOH溶液 | 测定中和热 | 粗铜精炼 | 比较 |
装置或操作 |
|
|
|
|
A . A
B . B
C . C
D . D
最近更新


 ,并防止倒吸
,并防止倒吸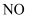
 的Ka和
的Ka和 的Ka1大小
的Ka1大小