е…ғзҙ е‘ЁжңҹиЎЁдёӯеҺҹеӯҗз»“жһ„дёҺе…ғзҙ жҖ§иҙЁзҡ„йҖ’еҸҳ规еҫӢ зҹҘиҜҶзӮ№йўҳеә“
X | Y | |||
Z | W | |||
M |
-
пјҲ1пјү дёӢеҲ—иғҪиҜҙжҳҺзўігҖҒзЎ«дёӨз§Қе…ғзҙ йқһйҮ‘еұһжҖ§зӣёеҜ№ејәејұзҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүгҖҒ
aпјҺзӣёеҗҢжқЎд»¶дёӢж°ҙжә¶ж¶Ізҡ„pHпјҡNa2CO3пјһNa2SO4
bпјҺй…ёжҖ§пјҡH2SO3пјһH2CO3
cпјҺCS2дёӯзўіе…ғзҙ дёә+4д»·пјҢзЎ«е…ғзҙ дёәп№Ј2д»·
-
пјҲ2пјү зҫ°еҹәзЎ«пјҲCOSпјүеҸҜдҪңдёәдёҖз§ҚзҶҸи’ёеүӮпјҢиғҪйҳІжӯўжҹҗдәӣжҳҶиҷ«гҖҒзәҝиҷ«зҡ„еҚұе®іпјҢе…¶еҲҶеӯҗз»“жһ„е’ҢCO2зӣёдјјпјҺзҫ°еҹәзЎ«пјҲCOSпјүзҡ„з”өеӯҗејҸдёәпјҺ
в‘ йҳҙзҰ»еӯҗзҡ„иҝҳеҺҹжҖ§жҢүXпјҢYпјҢZйЎәеәҸеҮҸејұ
в‘ЎеҚ•иҙЁзҡ„ж°§еҢ–жҖ§жҢүXпјҢYпјҢZйЎәеәҸеўһејә
в‘ўе…ғзҙ зҡ„еҺҹеӯҗеҚҠеҫ„жҢүXпјҢYпјҢZйЎәеәҸеҮҸе°Ҹ
в‘Јж°”жҖҒж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§жҢүXпјҢYпјҢZйЎәеәҸеҮҸејұпјҺ
йҖүйЎ№ | е®һйӘҢж“ҚдҪң | зҺ°иұЎ | з»“и®ә |
A | еҗ‘и”—зі–дёӯеҠ е…Ҙжө“зЎ«й…ё | и”—зі–еҸҳжҲҗз–ҸжқҫеӨҡз©әзҡ„жө·з»өзҠ¶зўі | жө“зЎ«й…ёе…·жңүеҗёж°ҙжҖ§е’Ңејәж°§еҢ–жҖ§ |
B | з”ЁжҙҒеҮҖй“ӮдёқиҳёеҸ–жә¶ж¶ІиҝӣиЎҢз„°иүІеҸҚеә” | зҒ«з„°е‘Ҳй»„иүІ | еҺҹжә¶ж¶ІдёӯжңүNa+ пјҢ ж— K+ |
C | еҗ‘зӣӣNa2SiO3жә¶ж¶Ізҡ„иҜ•з®Ўдёӯж»ҙеҠ 1ж»ҙй…ҡй…һпјҢ然еҗҺйҖҗж»ҙеҠ е…ҘзЁҖзӣҗй…ёиҮізәўиүІиӨӘеҺ» | 2minеҗҺпјҢиҜ•з®ЎйҮҢеҮәзҺ°еҮқиғ¶ | йқһйҮ‘еұһжҖ§пјҡCl>Si |
D | е°Ҷ0.1molВ·LпјҚ1MgSO4жә¶ж¶Іж»ҙе…ҘNaOHжә¶ж¶ІиҮідёҚеҶҚжңүжІүж·Җдә§з”ҹпјҢеҶҚж»ҙеҠ 0.1molВ·LпјҚ1CuSO4жә¶ж¶І | е…ҲжңүзҷҪиүІжІүж·Җз”ҹжҲҗеҗҺеҸҳдёәи“қиүІжІүж·Җ | Cu(OH)2зҡ„KspжҜ”Mg(OH)2зҡ„е°Ҹ |
| W | ||||
| X | Y | Z |
 B . еёёжё©еёёеҺӢдёӢпјҢYеҚ•иҙЁдёәеӣәжҖҒ
C . ж°”жҖҒж°ўеҢ–зү©зғӯзЁіе®ҡжҖ§пјҡ
B . еёёжё©еёёеҺӢдёӢпјҢYеҚ•иҙЁдёәеӣәжҖҒ
C . ж°”жҖҒж°ўеҢ–зү©зғӯзЁіе®ҡжҖ§пјҡ  D . Xзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©жҳҜејәзўұ
D . Xзҡ„жңҖй«ҳд»·ж°§еҢ–зү©зҡ„ж°ҙеҢ–зү©жҳҜејәзўұ
|
дё»ж—Ҹ е‘Ёжңҹ |
в… A |
в…ЎA |
в…ўA |
в…ЈA |
в…ӨA |
в…ҘA |
в…ҰA |
0 |
|
2 |
в‘Ҙ |
в‘Ұ |
⑧ |
|||||
|
3 |
в‘ |
в‘ў |
в‘Ө |
в‘Ё |
в‘© |
|||
|
4 |
в‘Ў |
в‘Ј |
-
пјҲ1пјү I. иҝҷ10з§Қе…ғзҙ дёӯпјҢеҢ–еӯҰжҖ§иҙЁжңҖдёҚжҙ»жіјзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүпјҢйқһйҮ‘еұһжҖ§жңҖејәзҡ„е…ғзҙ жҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ2пјү в‘ в‘ўв‘Өдёүз§Қе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӯпјҢзўұжҖ§жңҖејәзҡ„еҢ–еҗҲзү©зҡ„з”өеӯҗејҸжҳҜгҖӮ
-
пјҲ3пјү в‘ в‘Ўв‘ўдёүз§Қе…ғзҙ зҡ„еҺҹеӯҗеҚҠеҫ„з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜпјҲеЎ«е…ғзҙ з¬ҰеҸ·пјүгҖӮ
-
пјҲ4пјү жҹҗе…ғзҙ зҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©ж—ўиғҪдёҺй…ёеҸҲиғҪе’ҢзўұеҸҚеә”з”ҹжҲҗзӣҗе’Ңж°ҙпјҢеҗ‘иҜҘе…ғзҙ е’Ңв‘ЁеҸ·е…ғзҙ еҪўжҲҗзҡ„еҢ–еҗҲзү©зҡ„жә¶ж¶ІдёӯпјҢзј“ж…ўж»ҙеҠ ж°ўж°§еҢ–й’ жә¶ж¶ІиҮіиҝҮйҮҸпјҢдә§з”ҹзҡ„е®һйӘҢзҺ°иұЎжҳҜгҖӮ
-
пјҲ5пјү II.дёӢеҲ—зү©иҙЁдёӯпјҡв‘ N2 в‘ЎCO2 в‘ўNH3 в‘ЈNa2O в‘ӨNa2O2 в‘ҘNaOH в‘Ұ NH4Cl ⑧ H2O2
ж—ўеҗ«жңүжһҒжҖ§й”®еҸҲеҗ«жңүйқһжһҒжҖ§й”®зҡ„жҳҜпјӣ(еЎ«еәҸеҸ·)
-
пјҲ6пјү жҷ¶дҪ“дёӯйҳізҰ»еӯҗйҳҙзҰ»еӯҗдёӘж•°жҜ”дёә2:1зҡ„жңү(еЎ«еәҸеҸ·)
-
пјҲ7пјү еҗ«жңүй…ҚдҪҚй”®зҡ„жҳҜ(еЎ«еәҸеҸ·)
-
пјҲ8пјү йқһжһҒжҖ§еҲҶеӯҗжңү(еЎ«еәҸеҸ·)
-
пјҲ1пјү еҶҷеҮәиҝҷдёӨз§Қе…ғзҙ з¬ҰеҸ·пјҡAпјҢBгҖӮ
-
пјҲ2пјү з”Ёз¬ҰеҸ·иЎЁзӨәAзҰ»еӯҗз»“жһ„зӨәж„ҸеӣҫпјҡAгҖӮ
-
пјҲ3пјү з”Ёз”өеӯҗејҸиЎЁзӨәAгҖҒBеҪўжҲҗеҢ–еҗҲзү©зҡ„иҝҮзЁӢпјҡгҖӮ
в‘ HClжҜ”H2SзЁіе®ҡв‘ЎHClOж°§еҢ–жҖ§жҜ”H2SO4ејәв‘ўHClO4й…ёжҖ§жҜ”H2SO4ејәв‘ЈClеҺҹеӯҗжңҖеӨ–еұӮжңү7дёӘз”өеӯҗпјҢSеҺҹеӯҗжңҖеӨ–еұӮжңү6дёӘз”өеӯҗв‘ӨCl2дёҺFeеҸҚеә”з”ҹжҲҗFeCl3 пјҢ SдёҺFeеҸҚеә”з”ҹжҲҗFeS
 пјҢе…¶дёӯXе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°дёә
пјҢе…¶дёӯXе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°дёә 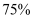 гҖӮYеҺҹеӯҗзҡ„еҶ…еұӮз”өеӯҗжҖ»ж•°жҳҜе…¶жңҖеӨ–еұӮз”өеӯҗж•°зҡ„2.5еҖҚгҖӮZе…ғзҙ еҺҹеӯҗзҡ„еӨ–еӣҙз”өеӯҗжҺ’еёғдёә
гҖӮYеҺҹеӯҗзҡ„еҶ…еұӮз”өеӯҗжҖ»ж•°жҳҜе…¶жңҖеӨ–еұӮз”өеӯҗж•°зҡ„2.5еҖҚгҖӮZе…ғзҙ еҺҹеӯҗзҡ„еӨ–еӣҙз”өеӯҗжҺ’еёғдёә  гҖӮWе…ғзҙ еҺҹеӯҗзҡ„жңӘжҲҗеҜ№з”өеӯҗж•°еңЁеүҚеӣӣе‘ЁжңҹдёӯжңҖеӨҡгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
гҖӮWе…ғзҙ еҺҹеӯҗзҡ„жңӘжҲҗеҜ№з”өеӯҗж•°еңЁеүҚеӣӣе‘ЁжңҹдёӯжңҖеӨҡгҖӮдёӢеҲ—жңүе…іиҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
 зҡ„ж°ҙеҗҲзү©пјҢиҝҮеәҰејҖйҮҮе®№жҳ“йҖ жҲҗжё©е®Өж•Ҳеә”
B . XдёҺYеҪўжҲҗеҢ–еҗҲзү©ж—¶пјҢXе‘ҲжӯЈд»·
C . Wе…ғзҙ зҡ„д»·з”өеӯҗжҺ’еёғејҸдёә
зҡ„ж°ҙеҗҲзү©пјҢиҝҮеәҰејҖйҮҮе®№жҳ“йҖ жҲҗжё©е®Өж•Ҳеә”
B . XдёҺYеҪўжҲҗеҢ–еҗҲзү©ж—¶пјҢXе‘ҲжӯЈд»·
C . Wе…ғзҙ зҡ„д»·з”өеӯҗжҺ’еёғејҸдёә  D . еӣӣз§Қе…ғзҙ зҡ„жңҖй«ҳеҢ–еҗҲд»·пјҡ
D . еӣӣз§Қе…ғзҙ зҡ„жңҖй«ҳеҢ–еҗҲд»·пјҡ 
 B . еҺҹеӯҗеҚҠеҫ„еӨ§е°Ҹпјҡ
B . еҺҹеӯҗеҚҠеҫ„еӨ§е°Ҹпјҡ C . зўұжҖ§ејәејұпјҡ
C . зўұжҖ§ејәејұпјҡ D . йҮ‘еұһжҖ§ејәејұпјҡ
D . йҮ‘еұһжҖ§ејәејұпјҡ
 гҖҒ
гҖҒ гҖҒ
гҖҒ гҖҒ
гҖҒ жҳҜе‘ЁжңҹиЎЁдёӯзҡ„зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ гҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
жҳҜе‘ЁжңҹиЎЁдёӯзҡ„зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ гҖӮдёӢеҲ—жңүе…іиҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 C . еҺҹеӯҗеҚҠеҫ„rпјҡ
C . еҺҹеӯҗеҚҠеҫ„rпјҡ D . еӣ дёәж°ҙеҲҶеӯҗй—ҙеҗ«жңүж°ўй”®пјҢж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§
D . еӣ дёәж°ҙеҲҶеӯҗй—ҙеҗ«жңүж°ўй”®пјҢж°ўеҢ–зү©зҡ„зЁіе®ҡжҖ§



