活化能及其对化学反应速率的影响 知识点
活化能对反应速率的影响:当活化能较小时,比如加入催化剂后,活化能会降低,致使普通分子变成活化分子更容易,活化分子百分数增大,导致碰撞后发生反应的几率增大,导致反应速率会增大。
活化能及其对化学反应速率的影响 知识点题库
 催化剂活性
催化剂活性 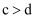 B .
B . 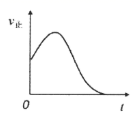
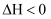 ,在恒容绝热容器中投入一定量
,在恒容绝热容器中投入一定量  和
和  ,正反应速率随时间变化
C .
,正反应速率随时间变化
C . 
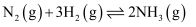
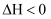 ,t时刻改变某一条件,则
,t时刻改变某一条件,则  D .
D . 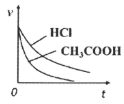 向等体积等pH的HCl和
向等体积等pH的HCl和  中加入等量且足量Zn,反应速率的变化情况
中加入等量且足量Zn,反应速率的变化情况
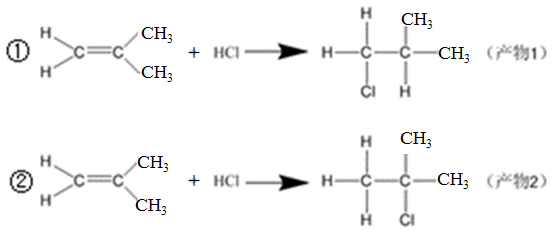
-
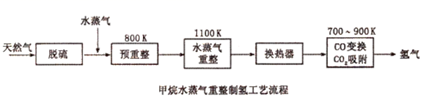
(1) 涉及的甲烷水蒸气重整反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1
CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH2=+165kJ·mol-1
已知CH4、CO、H2的燃烧热分别为ΔH=-891kJ·mol-1、ΔH=-283kJ·mol-1、ΔH=-286kJ·mol-1、水的汽化热ΔH=+44kJ·mol-1 , 则ΔH1=。
-
(2) 天然气脱硫工艺中常用热分解法处理H2S,硫化氢分解的反应方程式为:2H2S(g)=2H2(g)+S2(g),在101kPa时各气体的平衡体积分数与温度的关系如图所示:
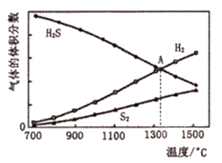
该反应的ΔH0(填“>”、“<”)。图中A点时反应的平衡常数Kp=(用平衡分压代替平衡浓度,平衡分压=总压X物质的量分数)。
-
(3) 利用甲烷水蒸气重整制得的氢气,工业上可用于合成氨生产。
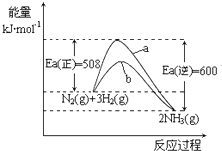
①“哈伯法”是制氨气的常用方法,反应方程式为:N2(g)+3H2(g)
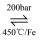 2NH3(g)向密闭容器中按1:3体积比通入N2和H2 , 反应达平衡时NH3的体积分数为25.0%,则N2的平衡转化率α(N2)=
2NH3(g)向密闭容器中按1:3体积比通入N2和H2 , 反应达平衡时NH3的体积分数为25.0%,则N2的平衡转化率α(N2)=②“球磨法”是一种在温和的条件下(45℃和1bar,1bar≈100kPa)合成氨气的新方法,氨的最终体积分数可高达82.5%。该法分为两个步骤(如图):第一步,铁粉在球磨过程中被反复剧烈碰撞而活化,产生高密度的缺陷,氮分子被吸附在这些缺陷上[Fe(N*)],有助于氮分子的解离。第二步,N*发生加氢反应得到NHx*(x=1~3),剧烈碰撞中,NHx*从催化剂表面脱附得到产物氨。“球磨法”与“哈伯法”相比较,下列说法中错误的是(选填标号)。

A.催化剂(Fe)缺陷密度越高,N2的吸附率越高
B.“哈伯法”采用高温主要用于解离氮氮三键,而“球磨法”不用解离氮氮三键
C.“球磨法”转速不能过快,否则体系升温太快,温度升高不利于N2吸附
D.“球磨法”不采用高压,是因为低压产率已经较高,加压会增大成本
-
(4) 用催化剂Fe3(CO)12/ZSM-5催化CO2加氢合成乙烯的反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。
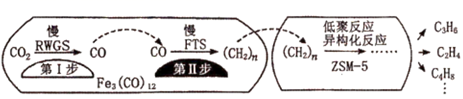
催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如表。
助剂
CO2转化率(%)
各产物在有机产物中的占比(%)
C2H4
C3H6
其他有机物
Na
42.5
35.9
39.6
24.5
K
27.2
75.6
22.8
1.6
Cu
9.8
80.7
12.5
6.8
欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加助剂效果最好,加入助剂能提高单位时间内乙烯产量的根本原因是。
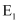 、
、  均减小,反应速率加快
均减小,反应速率加快
 ,则石墨比金刚石稳定
C . 在一恒容密闭容器中发生反应
,则石墨比金刚石稳定
C . 在一恒容密闭容器中发生反应  ,仅增加
,仅增加 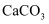 的质量,反应速率加快
D . 对于反应
的质量,反应速率加快
D . 对于反应 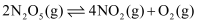 ,反应达到平衡后,保持其他条件不变,增大压强,化学平衡常数增大
,反应达到平衡后,保持其他条件不变,增大压强,化学平衡常数增大
下列说法错误的是( )
 (g)→
(g)→ (l)→
(l)→ (s),熵依次增加
B . 可逆反应都有一定的限度,限度越大反应物的转化率一定越高
C . 可逆反应,若总键能:反应物>生成物,则升高温度不利于提高反应物的转化率
D . 对于气体反应,其他条件不变,增大压强反应速率加快,与活化分子的百分含量无关
(s),熵依次增加
B . 可逆反应都有一定的限度,限度越大反应物的转化率一定越高
C . 可逆反应,若总键能:反应物>生成物,则升高温度不利于提高反应物的转化率
D . 对于气体反应,其他条件不变,增大压强反应速率加快,与活化分子的百分含量无关
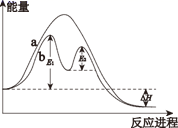
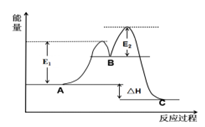
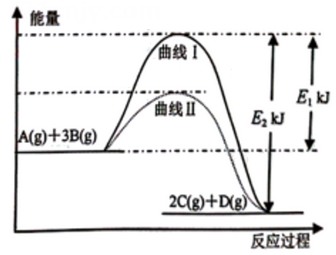
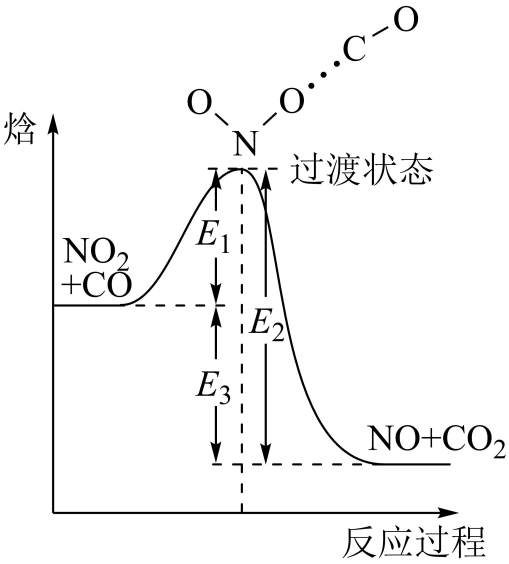
 2C(g)+D(g), 其反应过程和能量能量变化如图所示,下列说法正确的是( )
2C(g)+D(g), 其反应过程和能量能量变化如图所示,下列说法正确的是( )
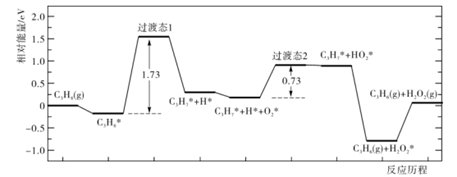
 C6H5OH(g)+N2(g)。
C6H5OH(g)+N2(g)。
-
(1) 已知6C(s,石墨)+3H2(g)
 C6H6(g) ΔH1=+82.9kJ·mol-1
C6H6(g) ΔH1=+82.9kJ·mol-1
2N2(g)+O2(g)
 2N2O(g) ΔH2=+163.2kJ·mol-1
2N2O(g) ΔH2=+163.2kJ·mol-112C(s,石墨)+6H2(g)+O2(g)
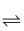 2C6H5OH(g) ΔH3=-243kJ·mol-1
2C6H5OH(g) ΔH3=-243kJ·mol-1则C6H6(g)+N2O(g)
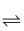 C6H5OH(g)+N2(g) ΔH=kJ·mol-1。
C6H5OH(g)+N2(g) ΔH=kJ·mol-1。 -
(2) 制备苯酚的苯和N2O的最佳投料比为10:1。此时,N2O、N2的平衡浓度分别为0.050mol/L、0.95mol/L。则制备反应的平衡常数Kc=(写出计算式)。
-
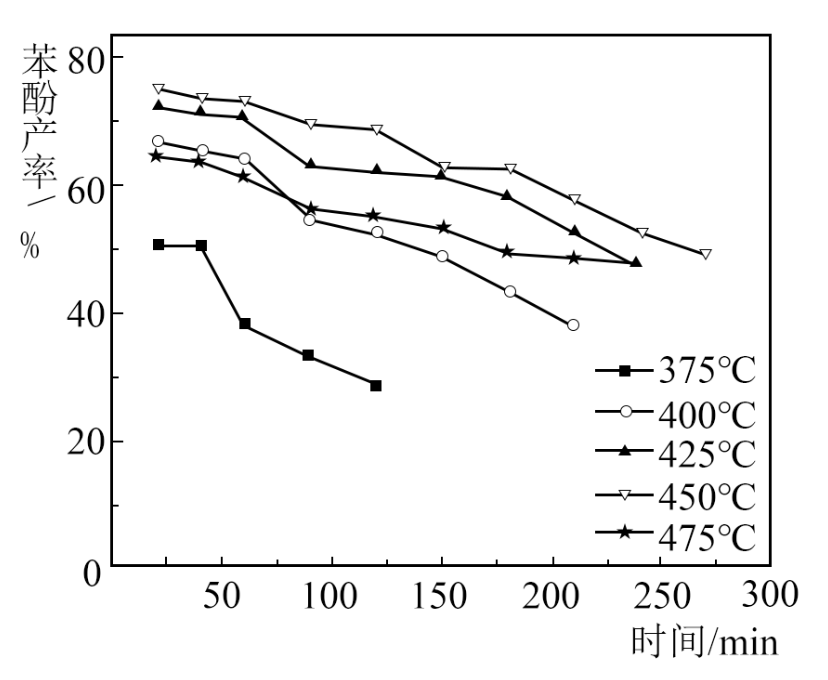
(3) 如图中,温度过低造成苯酚产率低的主要原因是;反应时间过长造成产率下降的可能原因是。
-
(4) 反应中使用更高效的催化剂(填“可”或“不可”)提高反应的平衡转化率。已知475℃下反应仍未达到平衡,此时的苯酚产率比450℃时的低,可能原因是。
-
(5) 研究表明,反应速率符合关系式v=kca(C6H6)cb(N2O),有关数据如表:
c(C6H6)/×10-3mol·L-1
c(N2O)/×10-3mol·L-1
v/×10-3mol·L-1·s-1
12
8.0
1.0
24
8.0
2.0
24
24
6.0
有人据此提出反应可分为三个步骤:
①N2O→N2+O*(活性氧) 快反应
②C6H6+O*→C6H5OH*(活性苯酚) 慢反应
③C6H5OH*→C6H5OH 快反应
下列有关说法正确的是____。
A . O*(活性氧)是该反应的催化剂 B . ②的反应的活化能最小 C . 反应速率v(N2O)=v(N2) D . 第二步中C6H6与O*的碰撞仅部分有效
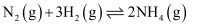
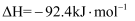 。
。
-
(1) 已知
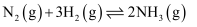 的活化能
的活化能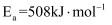 , 则氨分解反应:
, 则氨分解反应: 的活化能
的活化能
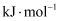 。
。
-
(2) 在一体积为2L的恒容刚性密闭容器中发生反应:
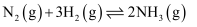 。在
。在 、
、 时刻改变反应的一个条件,Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的物质的量随时间变化的曲线如图所示:
时刻改变反应的一个条件,Ⅰ、Ⅱ、Ⅲ阶段体系中各物质的物质的量随时间变化的曲线如图所示: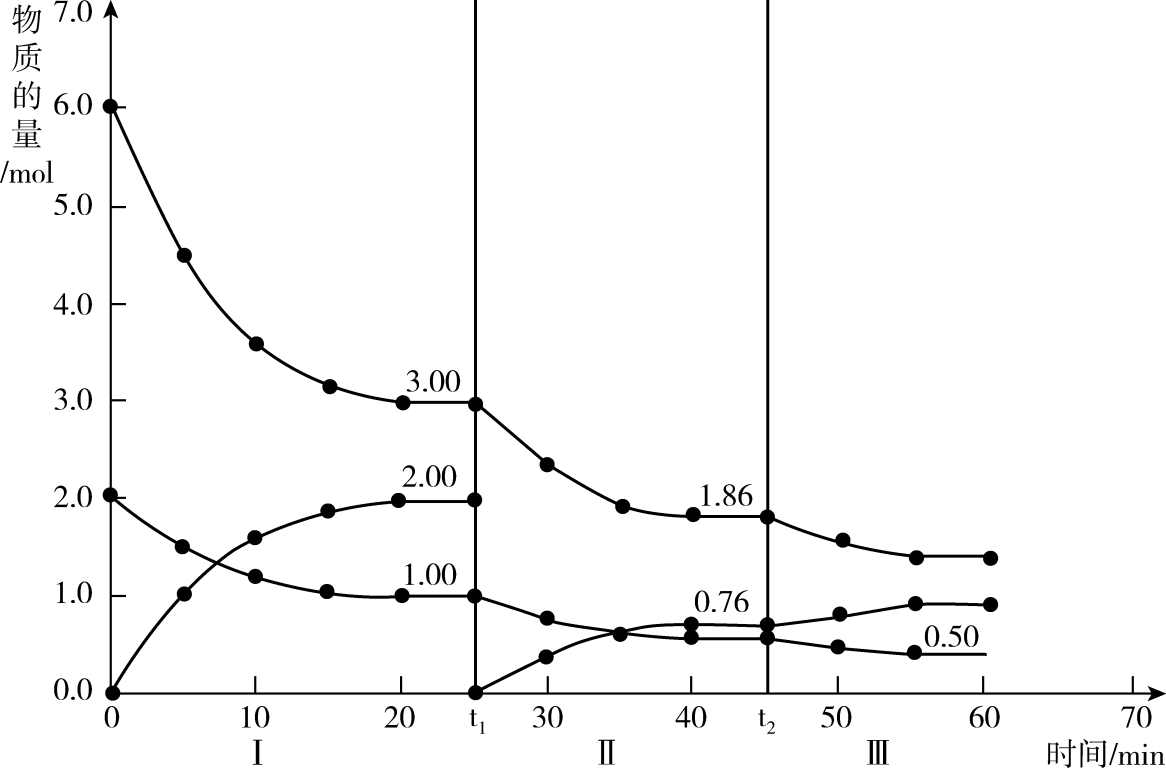
①第Ⅰ阶段的平衡常数
 为(保留2位有效数字)。
为(保留2位有效数字)。②比较第Ⅱ阶段和第Ⅲ阶段平衡常数的大小:
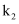
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。 -
(3) ①合成氨工业上通常采用铁触媒、在400~500℃和10MPa~30MPa的条件下合成氨,在Fe催化剂作用下的反应历程为(*表示吸附态)
化学吸附:
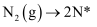 ;
;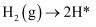 ;
;表面反应:
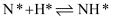 ;
; ;
;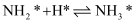
脱附:
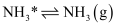
其中,
 的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。下列说法正确的是。
的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。下列说法正确的是。A.控制温度400~-500℃远高于室温,是为了保证尽可能的平衡转化率和快的反应速率
B.实际工艺中原料中
 和
和 物质的量之比为1∶2.8,氮气过量除了提高氢气的转化率,还可以提高整体反应速率
物质的量之比为1∶2.8,氮气过量除了提高氢气的转化率,还可以提高整体反应速率C.基于
 分子间有较强分子间作用力可将其液化,不断将液氨移去,有利于反应正向进行
分子间有较强分子间作用力可将其液化,不断将液氨移去,有利于反应正向进行D.
 、
、 的混合气只需一次通过合成塔
的混合气只需一次通过合成塔②我国科学家以
 为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。
为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。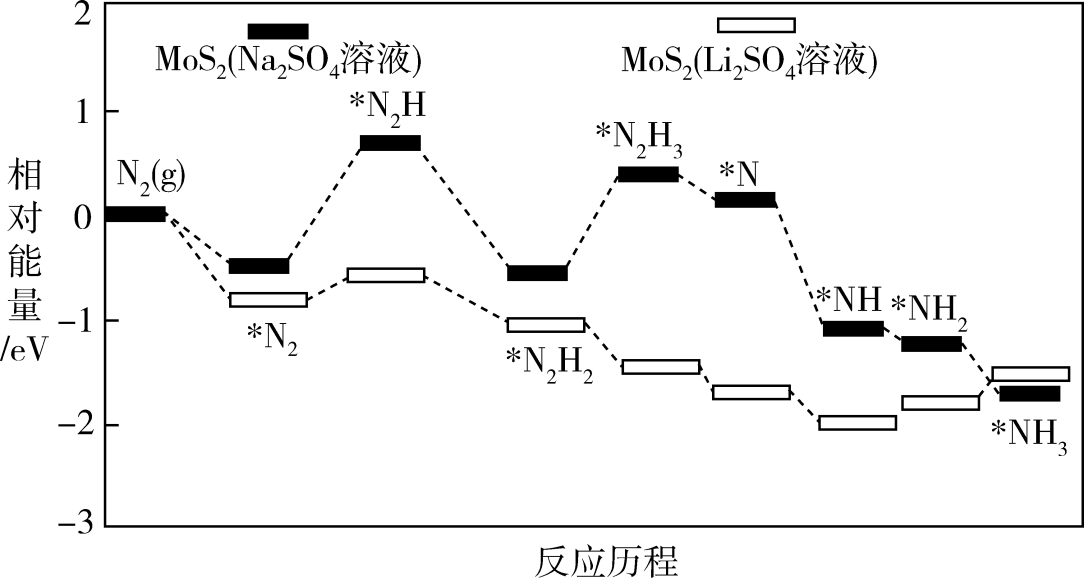
 在(填“
在(填“ ”或“
”或“ ”)溶液中催化效果更好:在
”)溶液中催化效果更好:在 溶液与
溶液与 溶液中,反应
溶液中,反应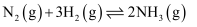 中的
中的 (填“前者大”“后者大”或“一样大”)。
(填“前者大”“后者大”或“一样大”)。
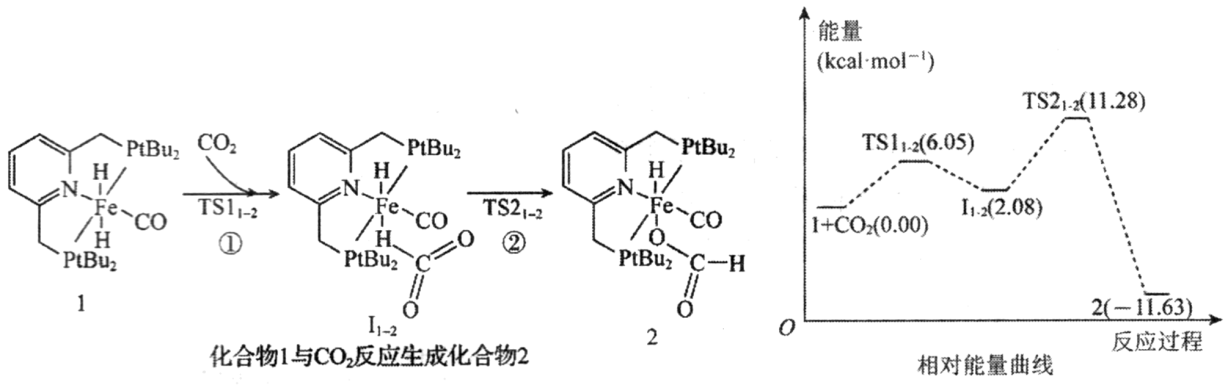
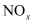 、
、 等)是主要的污染物之一,消除含氮化合物的污染倍受关注。
等)是主要的污染物之一,消除含氮化合物的污染倍受关注。
-
(1) 已知反应
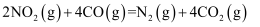
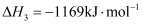 , 该逆反应活化能为
, 该逆反应活化能为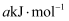 , 则其正反应活化能为
, 则其正反应活化能为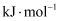 。(用含a的代数式表示)。
。(用含a的代数式表示)。
-
(2) 某种含二价铜微粒
 的催化剂可用于汽车尾气脱氮。催化机理如图1,反应历程如图2。
的催化剂可用于汽车尾气脱氮。催化机理如图1,反应历程如图2。
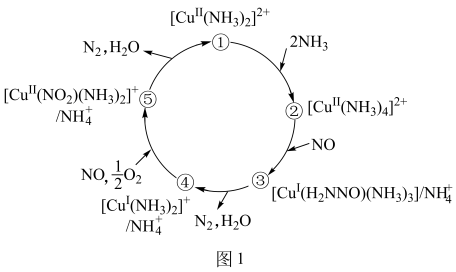
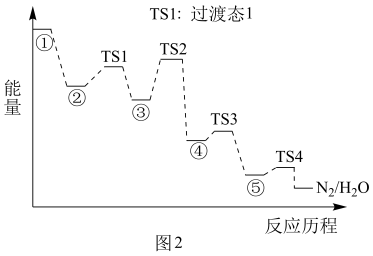
①从化学键的角度解释
 能结合
能结合 的原因:。
的原因:。②该脱氮过程的总反应方程式为。该反应历程的决速步骤是。(填选项)
a.状态①→状态② b.状态②→状态③
c.状态③→状态④ d.状态④→状态⑤
-
(3) 一种电解法处理含有
 、
、 的酸性废水,其工作原理及电极b中铁的化合物的催化机理如图3所示,H表示氢原子。
的酸性废水,其工作原理及电极b中铁的化合物的催化机理如图3所示,H表示氢原子。
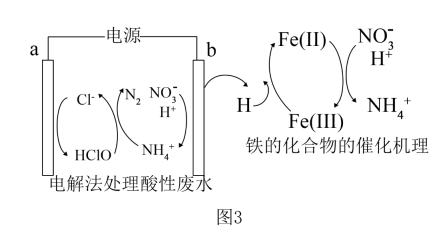
①写出阳极的电极反应方程式。
②电极b上铁的化合物催化含
 的酸性废水过程可描述为。
的酸性废水过程可描述为。
 加氢制
加氢制 是碳治理的重要方法,有利于实现碳资源的循环利用,体系中主要反应有:
是碳治理的重要方法,有利于实现碳资源的循环利用,体系中主要反应有:①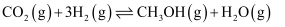
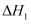
②

-
(1) 下表是部分化学键的键能数据
化学键

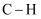
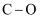
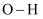
键能(
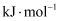 )
)803
436
414
326
464
 。反应①在(填“高温”或“低温”)条件下能自发进行。
。反应①在(填“高温”或“低温”)条件下能自发进行。 -
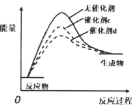
(2) 反应①在不同催化剂作用下的反应历程如图所示,催化效果更好的是(填“
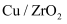 ”或“
”或“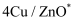 ”),判断依据是。
”),判断依据是。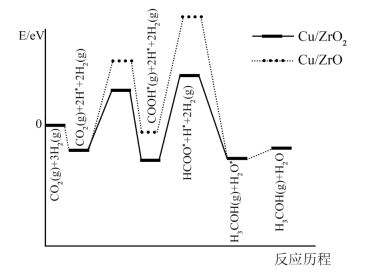
-
(3) 一定温度下,向容积为1L的密闭容器中加入1 mol
 和3 mol
和3 mol 发生反应①和②,达到平衡状态,
发生反应①和②,达到平衡状态, 平衡转化率为20%,
平衡转化率为20%, 的物质的量浓度为
的物质的量浓度为 ,
,  的选择性=(
的选择性=( 的选择性
的选择性 ),反应①在该温度下的平衡常数
),反应①在该温度下的平衡常数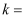
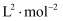 (写出计算式)。
(写出计算式)。
-
(4) 为提高
 的平衡产率,最佳反应条件为____。
A . 高温高压 B . 高温低压 C . 低温高压 D . 低温低压
的平衡产率,最佳反应条件为____。
A . 高温高压 B . 高温低压 C . 低温高压 D . 低温低压



