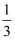等效平衡 知识点题库
-
(1) 下表为不同温度下该反应的平衡常数.由此可推知,表中T1T2(填“>”“=”或“<”).
T/K
T1
T2
T3
K
1.00×107
2.45×105
1.88×103
若在原来的容器中,只加入2mol C,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度(填“>”、“=”或“<”)w mol/L,a、b、c之间满足何种关系(用代数式表示).
-
(2) 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是( )A . 4mol A和2mol B B . 4mol A、2mol B和2mol C C . 4mol A和4mol B D . 6mol A和4mol B
-
(3) 为使该反应的反应速率增大,且平衡向正反应方向移动的是( )A . 及时分离出C气体 B . 适当升高温度 C . 增大B的浓度 D . 选择高效催化剂
-
(4) 若将上述容器改为恒压容器(反应前体积相同),起始时加入2mol A和1mol B,500℃时充分反应达平衡后,放出热量为d kJ,则db(填“>”“=”或“<”).
-
(5) 在一定温度下,向一个容积可变的容器中,通入3mol A和2mol B及固体催化剂,使之反应,平衡时容器内气体压强为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为4mol A、3mol B和2mol C,则平衡时A的百分含量(填“不变”“变大”“变小”或“无法确定”).
(1)平衡后继续向容器中充入惰性气体,平衡移动。(填“正向”,“逆向”,“不”)
(2)用A表示2分钟内平均反应速率
A在第1分钟平均速率 第2分钟平均速率(填“<”、“>”、“=”).
(3)容器温度升高,平衡时混合气体的平均相对分子质量减小,则正反应为 (填“吸热”或“放热”)反应.
(4)为了增大B的转化率,可采取的措施是 (用序号填空)
①加入A ②加入B ③加压
④再加入1.6mol A+0.8mol B ⑤将C分离出容器
(5)体积可变,维持容器压强和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2mol/L的是 (用序号填空)
①4mol A+2mol B
②3mol C+1mol D+1mol B
③3mol C+2mol D
④1.6mol A+0.8mol B+0.6mol C+0.2mol D
( )


-
(1) 该容器恒容,则x、y、z应满足的关系是.
-
(2) 该容器恒压,则x、y、z应满足的关系是.
-
(3) 设前者达到平衡时生成NH3为amol,则后者达到平衡时生成NH3=mol(用a、x、z表示)
 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2 , 在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1 , 放出热量b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2 , 在500 ℃时充分反应达到平衡后C的浓度为w mol·L-1 , 放出热量b kJ。
-
(1) a(填“>”“=”或“<”)b。
-
(2) 若将反应温度升高到700 ℃,该反应的平衡常数将 (填“增大”“减小”或“不变”)。
-
(3) 若在原来的容器中只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量c kJ,C的浓度(填“>”“=”或“<”)w mol·L-1。
-
(4) 能说明该反应已经达到平衡状态的是。
a.v(C)=2v(B2)
b.容器内压强保持不变
c.v逆(A2)=2v正(B2)
d.容器内气体的密度保持不变
-
(5) 使该反应的反应速率增大,且平衡向正反应方向移动的操作是。
a.及时分离出C气体
b.适当升高温度
c.增大B2的浓度
d.选择高效的催化剂
CO(g)+H2O(g)  H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是( )
H2(g)+CO2(g)△H>0。当反应达平衡时,测得容器中各物质均为n mol,欲使H2的平衡浓度增大一倍,在其它条件不变时,下列措施可以采用的是( )
 N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
N2O5(g)+O2(g),在T温度下,向2.0 L恒容密闭容器中充入2.0mol NO2和1.0mol O3 , 经过一段时间后达到平衡。反应过程中测定的部分数据见下表: | t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
下列有关说法正确的是( )
 3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是( )
3Z(g) △H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示,下列推断正确的是( ) 
 2HI(g) DH=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。
2HI(g) DH=-149kJ/mol。在甲、乙两个体积相同的密闭容器中充入反应物,保持恒温恒容,其起始浓度如下表所示。 | 起始 浓度 | c(H2)(mol/L) | c(I2)(mol/L) | c(HI)/(mol/L) |
| 甲 | 0.01 | 0.01 | 0 |
| 乙 | 0.02 | 0.02 | 0 |
甲中反应达到平衡时,测得c(H2)=0.008 mol/L下列判断正确的是( )
 3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
 2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
2C(g)+2D(g) ΔH=Q,2min末达到平衡,生成0.8molD。
-
(1) 300℃时,该反应的平衡常数表达式为:K=。已知K300℃<K350℃ , 则ΔH0(填“>”或“<”)。
-
(2) 在2min末时,B的平衡浓度为,D的平均反应速率为。
-
(3) 若温度不变,缩小容器容积,则A的转化率(填“增大”“减小”或“不变”),原因是。
-
(4) 如果在相同的条件下,上述反应从逆反应方向进行,开始时加入
C、D各
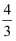 mol。欲使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入Bmol。
mol。欲使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入Bmol。
 PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2molPCl5 , 反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确的是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl5在混合气体中的体积分数为m%,若在相同的温度和相同的容器中,起始时加入2molPCl5 , 反应达到平衡时,PCl5在混合气体中的体积分数为n%,则m和n的关系正确的是( )
 2SO3(g) ΔH<0。下列说法错误的是
2SO3(g) ΔH<0。下列说法错误的是 

| 容器编号 | 容器类型 | 起始物质的量/mol | 平衡时SO3的 物质的量/mol | ||
| SO2 | O2 | SO3 | |||
| Ⅰ | 恒温恒容 | 2 | 1 | 0 | 1.8 |
| Ⅱ | 绝热恒容 | 0 | 0 | 2 | a |
| Ⅲ | 恒温恒压 | 2 | 1 | 0 | b |
 的恒容密闭容器中充入一定量的CO和
的恒容密闭容器中充入一定量的CO和  ,发生如下反应:
,发生如下反应: 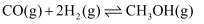 ,反应过程中测定的部分数据见表:
,反应过程中测定的部分数据见表: | 反应时间/min | | |
| 0 | 0.30 | 0.60 |
| 20 | 0.10 | |
| 30 | 0.20 |
下列说法正确的是( )
 ,则反应的
,则反应的 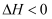 B . 反应在
B . 反应在  内的平均速率为
内的平均速率为  C . 保持其他条件不变,再向平衡体系中同时通入
C . 保持其他条件不变,再向平衡体系中同时通入  ,达到新平衡前v(正)<v(逆)
D . 相同温度下,若起始时向容器中充入
,达到新平衡前v(正)<v(逆)
D . 相同温度下,若起始时向容器中充入  ,达到平衡时
,达到平衡时  转化率大于
转化率大于