等效平衡 知识点
等效平衡 知识点题库
时间/min | CO(g) | H2O(g) | CO2(g) | H2(g) |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
-
(1) Q0(填“>”、“=”或“<”).
-
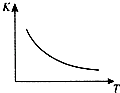
(2) 若在850℃时向反应容器中充人H2O(g),K值(填“增大”、“减小”或“不变”).
-
(3) 上表中 c2为 mol/L,CO(g)的转化率为.
-
(1) I若开始时放入1molA和1molB,到达平衡后,生成amolC,这时A的物质的量为mol.
-
(2) 若开始时放入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别是ymol和3amol,则x=mol,y=mol.
-
(3) 若在(2)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是.
-
(4) II 若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应.
开始时放入1molA和1molB到达平衡后生成bmolC.将b与(1)小题中的a进行比较(选填一个编号)
(甲)a<b (乙)a>b
(丙)a=b (丁)不能比较a和b的大小.
 2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
2HI(g) ΔH<0。实验测得:v正=v(H2)消耗=v(I2)消耗=k正c(H2)·c(I2),v逆=v(HI)消耗=k逆c2 (HI),k正、k逆为速率常数,受温度影响。下列说法正确的是( )容器 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度 | ||
c(H2) | c(I2) | c(HI) | ||
Ⅰ(恒容) | 0.1 | 0.1 | 0 | c(I2)=0.07 mol·L-1 |
Ⅱ(恒压) | 0 | 0 | 0.6 | |
 成立
D . 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆
成立
D . 达平衡时,向容器Ⅰ中同时再通入0.1 mol I2和0.1 mol HI,则此时ν正>ν逆
-
(1) Ⅰ.在一固定容积的密闭容器中,保持一定温度,在一定条件下进行如下反应: A(g)+2B(g)
 3C(g),已知起始时加入 3 mol A(g)和 2 mol B(g),达平衡后,生成 a mol C(g)。
3C(g),已知起始时加入 3 mol A(g)和 2 mol B(g),达平衡后,生成 a mol C(g)。 相同实验条件下,若在同一容器中改为开始加入 1.5 mol A 和 1 mol B,达平衡时 C 的 物质的量为mol(用含字母 a 的代数式表示),此时 C 在反应混合物中的体积分数 (填“增大”、“减小”或“不变”)。
-
(2) 相同实验条件下,若在同一容器中改为开始时加入 2 mol A 和 1 mol B,达平衡时,要 求 C 在混合物中体积分数与(1)相同,则开始时还需加入mol C。
-
(3) Ⅱ.向 BaSO4 中加入饱和 Na2CO3溶液,当溶液中 c(CO32-)=6 mol/L 时,有部分BaSO4转化成了 BaCO3 , 则此时 c(SO42-)=。(已知 Ksp(BaCO3)=2.6×10-9 , Ksp=(BaSO4)1.1×10-10)
-
(4) Ⅲ.25℃时,V1 L pH=2 的 HCl 和 V2 L pH=11 的 NaOH 溶液反应后 pH=9,则 V1∶V2= 。
 SO3(g)+NO(g)。投入NO2和SO2 , 起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是( )
SO3(g)+NO(g)。投入NO2和SO2 , 起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是( ) | 起始浓度 | 甲 | 乙 | 丙 |
| c(NO2)/(mol·L-1) | 0.10 | 0.20 | 0.20 |
| c(SO2)/(mol·L-1) | 0.10 | 0.10 | 0.20 |
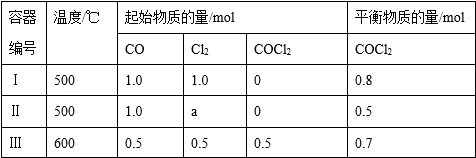
下列说法中正确的是( )
 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。-
(1) 比较ab(填“>”“=”或“<”)。
-
(2) 下表为不同温度下该反应的平衡常数。由此可推知,表中T1T2(填“>” “=”或“<”)。
T/K
T1
T2
T3
K
1.00×107
2.45×105
1.88×103
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系(用代数式表示)。
-
(3) 在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是 。A . 4molA和2molB B . 4molA,2molB和2molC C . 4molA和4molB D . 6molA和4molB
-
(4) 为使该反应的反应速率增大,且平衡向正反应方向移动的是 。A . 及时分离出C气体 B . 适当升高温度 C . 增大B的浓度 D . 选择高效催化剂
-
(5) 若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则db(填“>”“=”或“<”),理由是。
-
(6) 在一定温度下,向一个容积可变的容器中,通入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)
 2C(g) 平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量(填“不变”“变大”“变小”或“无法确定”)。
2C(g) 平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量(填“不变”“变大”“变小”或“无法确定”)。
 2NH3(g)
2NH3(g)  H=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表:
H=-92.6 kJ/mol,实验测得起始、平衡时的有关数据如下表: | 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体 系能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15 kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述不正确的是( )
 2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是( )
2E(g)。若开始时只充入2 mol E(g),达到化学平衡时,混合气体的压强比开始时增大了20%;若开始时只充入2 mol M(g)和1 mol N(g) 的混合气体,则达到化学平衡时M的转化率是( )
 N2+3H2 , 达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
N2+3H2 , 达到平衡时,容器内N2的百分含量为a%,若维持容器的体积和温度都不变,分别通入下列几组物质,达到平衡时,容器内N2的含量仍为a%的是( )
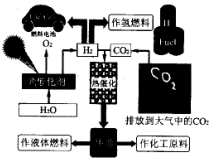
-
(1) 联系自然界的光合作用原理,并结合上述图示, 写出“人工”光合作用的化学方程式;;在图示转化过程中,太阳能除了储存在甲醇中,还储存在中(填化学式)。
-
(2) 图中热催化过程的反应原理为CO2(g) + 3H2(g) = CH3OH(g) + H2O(g)△H。
已知:2H2(g)+O2(g)=2H2O (g)△H1= -483.6 kJ•mo1-1;
2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H2=-1352.86 kJ•mol-1
△H =。
-
(3) 实验室对热催化反应进行模拟探究:一定温度下,向容积均为2 L 的恒容密闭容器中分别通入1.0 mol CO2(g)和3.0 mol H2(g), 在不同催化剂X、Y 的催化下发生反应。测得5 min时,CO2转化率与温度的变化关系如图所示。
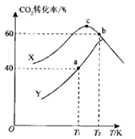
①该反应适宜选用的催化剂为(填“X'”或 “Y”)。
②T1K时,a点对应容器在0~5 min内的平均反应速率v(H2)=;b、c点对应状态下反应物的有效碰撞几率bc(填“>”“<”或“=”),原因为。
③T2K时,若反应前容器内的压强为p, 则该温度下反应的平衡常数KP=。 (KP为用分压表示的平衡常数)。
-
(4) 我国化学家结合实验和计算机模拟结果,研究得出热催化反应的一种可能历程如图所示,其中自由基用“•”标出,过渡态用TS表示。
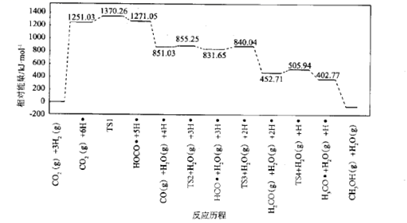
四个过渡态中对反应速率影响最大的是,理由为;该步骤的化学方程式为。
 cC(g)+dD(g) ΔH<0。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( )
cC(g)+dD(g) ΔH<0。当反应进行一段时间后,测得A减少了n mol,B减少了0.5n mol,C增加了1.5n mol,D增加了n mol,此时达到化学平衡状态则下列说法正确的是( ) 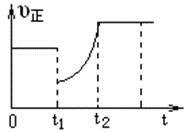
 ,在相同温度和催化剂的条件下,两容器中各自发生下列反应:
,在相同温度和催化剂的条件下,两容器中各自发生下列反应: 
 ;达到平衡时,
;达到平衡时, 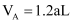 ,则下列说法错误的是( )
,则下列说法错误的是( ) 
-
(1) 已知25℃、101kPa时,以下反应的热化学方程式为:
4Fe(s)+3O2(g)=2Fe2O3(s) △H1=-1644kJ•mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-564kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393kJ•mol-1
则Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)的△H=kJ•mol-1。
-
(2) 已知反应NO(g)+O3(g)
 NO2(g)+O2(g) △H=-200.9kJ•mol-1在低温下自发进行,则该反应的熵变△S0(填“大于”或“小于”)。
NO2(g)+O2(g) △H=-200.9kJ•mol-1在低温下自发进行,则该反应的熵变△S0(填“大于”或“小于”)。
-
(3) Ⅱ.资料显示,在催化剂存在条件下,可分别用CO和CO2作碳源,均能与H2S反应产生羰基硫(COS),COS是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。具体反应如下:
反应1:CO(g)+H2S(g)
 COS(g)+H2(g) △H=-11.3kJ•mol-1
COS(g)+H2(g) △H=-11.3kJ•mol-1反应2:CO2(g)+H2S(g)
 COS(g)+H2O(g)
COS(g)+H2O(g)研究表明,反应1分两步完成,具体过程如下:
①2H2S(g)
 S2(g)+2H2(g) △H1=+168.9kJ•mol-1
S2(g)+2H2(g) △H1=+168.9kJ•mol-1②2CO(g)+S2(g)
 2COS(g) △H2
2COS(g) △H2已知,决定COS生成速率的步骤为第一步,请在图1中画出反应1两步过程的能量变化图(标清每步反应的产物和状态)。

-
(4) 在恒压密闭容器中,投入等物质的量的反应物,分别发生反应1和反应2。图2中,曲线a(实线)表示反应1在不同温度下反应相同时间t时,COS的物质的量分数;曲线b(虛线)表示反应2在不同温度下达到平衡时COS的物质的量分数。根据图中信息回答下列问题:
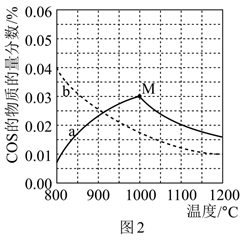
①由图2可知,反应2:CO2(g)+H2S(g)
 COS(g)+H2O(g)的△H0(填“>”或“<”),当温度升高时,反应2的化学平衡常数K(填“增大”、“减小”或“不变”),在a(绝热恒容)、b(恒温恒容)、c(恒温恒压)三个容器中,起始状态和投料等完全相同,如图3所示,反应达到平衡后,H2S的转化率由大到小的顺序为(用a、b、c表达)。
COS(g)+H2O(g)的△H0(填“>”或“<”),当温度升高时,反应2的化学平衡常数K(填“增大”、“减小”或“不变”),在a(绝热恒容)、b(恒温恒容)、c(恒温恒压)三个容器中,起始状态和投料等完全相同,如图3所示,反应达到平衡后,H2S的转化率由大到小的顺序为(用a、b、c表达)。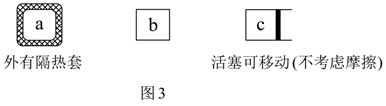
②图2中曲线a上,若M点反应1尚未达到平衡,则后面曲线变化的可能原因是;若M点反应1达到平衡,则请在图2中画出900℃~1100℃之间反应1平衡时COS的物质的量分数随温度的变化曲线。
 和
和
 , 发生反应:
, 发生反应:
 。
。
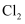 的消耗速率(v)、
的消耗速率(v)、
 的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )
的消耗速率(v)、温度(T)三者的关系如图所示,以下说法中不正确的是( )
 和
和
 ,
,
 的平衡转化率不变
D . 125℃,平衡时
的平衡转化率不变
D . 125℃,平衡时
 的消耗速率为0.015
的消耗速率为0.015
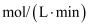
-
(1) I:2SO2(g)+O2(g)
 2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)
2SO3(g) ΔH1=-197.7kJ/mol K1(浓度平衡常数)为研究该反应,某同学设计了以下三种已装固体V2O5催化剂的密闭容器装置:

在初始体积与温度相同的条件下,甲、乙、丙中均按2 mol SO2、1molO2进行投料,达平衡时,三个容器中SO2的转化率从大到小的顺序为(用“甲、乙、丙”表示)。
-
(2) 在容器丙中,0.1 MPa条件下,在不同温度或不同投料方式下研究上述反应,得到数据如下表:
实验序号
A组
B组
C组
反应温度
451℃
451℃
551℃
投料方式(按照SO2、O2、SO3的顺序)
2 mol 、1mol、0 mol
0mol 、0mol 、2mol
2mol 、1mol 、0mol
含硫化合物的转化
60%
b
c
反应的热量变化
放热a
吸热79.08kJ
放热
压强平衡常数(Kp)
Kp1
Kp1
Kp2
①表中:a= 。
②已知用平衡分压(分压=总压×物质的量分数)代替平衡浓度计算,得到的平衡常数即为压强平衡常数,则Kp1=MPa-1。
③451℃时,若按0.4 mol SO2、0.4mol O2、0.4 mol SO3进行投料,则反应开始时v正(SO2)v逆(SO2)(填“>”、“<”或“=”)。
-
(3) 将上述固体催化剂V2O5换成NO2气体同样可以对该反应起到催化作用,此催化过程如下:
Ⅱ:SO2(g)+NO2(g)
 SO3(g)+NO(g) △H2 K2(浓度平衡常数)
SO3(g)+NO(g) △H2 K2(浓度平衡常数)Ⅲ:2NO(g)+O2(g)
 2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=;K3=(用含有K1、K2的表达式表示)。
2NO2(g) △H3=-114.1 kJ/mol K3(浓度平衡常数),△H2=;K3=(用含有K1、K2的表达式表示)。



