水的电离 知识点题库
已知温度T时水的离子积常数为Kw . 该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1的NaOH等体积混合,混合溶液中c(H+)=![]() mol•L﹣1 . 下列说法不正确的是( )
mol•L﹣1 . 下列说法不正确的是( )
A . 混合溶液呈中性
B . a≥b
C . 混合溶液中,c(A﹣)=c(Na+)
D . 混合液中水电离出c(OH﹣)大于该温度下纯水电离出c(OH﹣)
对水的电离平衡不产生影响的粒子是( )
A . HCl
B . Fe3+
C . Al3+
D . Cl﹣
25℃时,水的电离达到平衡:H2O⇌H++OH﹣ , 下列叙述正确的是( )
A . 向水中加入少量Na固体,平衡逆向移,c(H+)降低
B . 向水中加入稀氨水,平衡逆向移动,c(OH﹣)降低
C . 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动
D . 将水加热,Kw增大,pH不变
下列叙述正确的是( )
A . 95℃纯水的pH<7,说明加热可导致水呈酸性
B . 向水中加入少量稀硫酸,c(H+)增大,KW不变
C . 向水中加入氨水,水的电离平衡向正反应方向移动,c(OH﹣)增大
D . pH=3的醋酸溶液,稀释至10倍后pH=4
在相同温度下,0.01mol•L﹣1 NaOH溶液和0.01mol•L﹣1的盐酸相比,下列说法正确的是( )
A . 由水电离出的[H+]相等
B . 由水电离出的[H+]都是1.0×10﹣12 mol•L﹣1
C . 由水电离出的[OH﹣]都是0.01 mol•L﹣1
D . 两者都促进了水的电离
已知:100℃的溫度下,水的离子积Kw=1×10﹣12 . 下列说法正确的是( )
A . 0.05mol/L 的 H2SO4溶液 pH=1
B . 0.001mol/L 的 NaOH溶液 pH=11
C . 0.005mol/L的H2SO4溶液与0.01mol/LNaOH溶液等体积浪合,混合液pH=6,溶液呈酸性
D . 完全中和pH=3的H2SO4溶液50mL,需要pH=11的NaOH溶液50mL
常温下,下列离子能使纯水中的H+离子数目增加的是( )
A . S2-
B . CO32-
C . NH4+
D . Br-
HR是一元酸。室温时,用0.250 mo·L-1NaOH 溶液滴定25.0 mLHR溶液时,溶液的pH 变化情况如图所示。其中,b 点表示两种物质恰好完全反应。下列叙述正确的是( )

A . HR 的电离常数Ka=5×10-6
B . 图中X<7
C . a 点溶液中粒子浓度大小关系是:c(Na+)>c(R-)>c(HR)>c(H+)>c(OH-)
D . b 点溶液中粒子浓度大小关系是:c(Na+)>c(OH-)>c(R-)>c(H+)
电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )

A . 曲线①代表滴定氢氧化钠溶液的曲线
B . 滴定氨水的过程应该选择酚酞作为指示剂
C . b点溶液中:c(H+)>c(OH-)+c(NH4+)+c(NH3·H2O)
D . a、b、c、d四点的溶液中,水的电离程度最大的是c点
在某温度时,测得纯水中的c(H+)=2.0×10-7mol·L-1 , 则c(OH-)为( )
A . 2.0×10-7mol·L-1
B . 0.1×10-7mol·L-1
C . 1.0×10-14/(2.0×10-7) mol·L-1
D . 无法确定
25℃时,将浓度均为0.1mol/L、体积不同的HA溶液与BOH 溶液混合,保持溶液的总体积为100 mL,溶液的体积与混合液pH 的关系如图所示。下列说法正确的是( )

A . V1表示HA 溶液的体积,V2表示BOH 溶液的体积
B . Ka( HA) 和Kb( BOH) 的数量级相等,均为10-6
C . y点时,c(B+)=c(A-)=c(OH-)=c(H+)
D . x、y、z 所示三点时水的电离程度:y>x=z
向25 ℃时的纯水中通入一定量的HCl气体,当溶液的pH=2时,则由水电离出的c(H+)是( )
A . 1×10-2 mol·L-1
B . 1×10-8 mol·L-1
C . 1×10-12 mol·L-1
D . 1×10-4 mol·L-1
室温下,下列各组离子在指定溶液中能大量共存的是( )
A . 能使酚酞变红的溶液:Na+、Al3+、SO42-、NO3-
B . 0.1 mol/LNaClO溶液:K+、Fe2+、Cl-、SO42-
C . 0.1mol/L氨水:K+、Ag(NH3)2+、NO3-、OH-
D . 由水电离产生的c(H+)=1×10-13 mol/L的溶液:Na+、NH4+、Cl-、HCO3-
一定温度下,水溶液中H+和OH−的浓度变化曲线如图所示,下列说法正确的是( )

A . 升高温度,可能引起由c向b的变化
B . 该温度下,水的离子积常数为1.0×10−13
C . 该温度下,加入FeCl3可能引起由b向a的变化
D . 该温度下,稀释溶液可能引起由c向d的变化
常温下,在  溶液中,由水电离出的氢离子浓度是( )
溶液中,由水电离出的氢离子浓度是( )
 溶液中,由水电离出的氢离子浓度是( )
溶液中,由水电离出的氢离子浓度是( )
A .  B .
B . 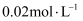 C .
C .  D .
D . 
 B .
B . 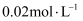 C .
C .  D .
D . 
室温时,下列说法正确的是( )
A . pH=11的氨水和pH=11的Na2CO3溶液中,由水电离产生的c(OH-)均为  B . 分别向100mLpH=11的NaOH溶液和氨水中加水稀释至1L,所得溶液pH均为10
C . 分别向1mLpH=3的盐酸溶液和醋酸溶液中加入少量CH3COONa固体,两溶液的pH均增大
D . 分别向等体积、浓度均为
B . 分别向100mLpH=11的NaOH溶液和氨水中加水稀释至1L,所得溶液pH均为10
C . 分别向1mLpH=3的盐酸溶液和醋酸溶液中加入少量CH3COONa固体,两溶液的pH均增大
D . 分别向等体积、浓度均为  的HCl溶液和CH3COOH溶液中加入等浓度的NaOH溶液,恰好为中性时,消耗NaOH溶液的体积相等
的HCl溶液和CH3COOH溶液中加入等浓度的NaOH溶液,恰好为中性时,消耗NaOH溶液的体积相等
 B . 分别向100mLpH=11的NaOH溶液和氨水中加水稀释至1L,所得溶液pH均为10
C . 分别向1mLpH=3的盐酸溶液和醋酸溶液中加入少量CH3COONa固体,两溶液的pH均增大
D . 分别向等体积、浓度均为
B . 分别向100mLpH=11的NaOH溶液和氨水中加水稀释至1L,所得溶液pH均为10
C . 分别向1mLpH=3的盐酸溶液和醋酸溶液中加入少量CH3COONa固体,两溶液的pH均增大
D . 分别向等体积、浓度均为  的HCl溶液和CH3COOH溶液中加入等浓度的NaOH溶液,恰好为中性时,消耗NaOH溶液的体积相等
的HCl溶液和CH3COOH溶液中加入等浓度的NaOH溶液,恰好为中性时,消耗NaOH溶液的体积相等
向VmL0.1mol/L氨水中滴加等物质的量浓度的稀H2SO4 , 测得混合溶液的温度和pOH[pOH=-lgc(OH-)]随着加入稀硫酸的体积的变化如图所示(实线为温度变化,虚线为pOH变化),下列说法错误的是( )

A . a、b、c三点由水电离的c(H+)依次减小
B . V=40
C . b点时溶液的pOH>pH
D . a、b、d三点对应NH3·H2O的电离常数:K(b)>K(d)>K(a)
已知:Ka(HA)=3.0×10-4 , Ka1(H2B)=4.3×10-2 , Ka2(H2B)=5.6×10-6。下列说法正确的是( )
A . 与等浓度等体积的HA,H2B溶液完全反应消耗NaOH的物质的量前者更大
B . pH=a的NaA溶液中,水电离出的c(OH-)为10-amol/L
C . 向NaA溶液滴加少量H2B溶液的离子方程式为:A-+H2B=HB-+HA
D . 向Na2B溶液滴加等浓度等体积的盐酸,充分反应后溶液呈碱性
下列有关叙述正确的是( )
A . 常温下,等体积的 的盐酸与
的盐酸与 的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、
的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、 溶液中,水的电离程度相同
C . 25℃时,
溶液中,水的电离程度相同
C . 25℃时, 的HA溶液中
的HA溶液中 , 则该溶液中由水电离出的
, 则该溶液中由水电离出的 D . 在饱和AgCl、AgBr的混合溶液中加入少量
D . 在饱和AgCl、AgBr的混合溶液中加入少量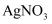 溶液,
溶液, 增大
增大
 的盐酸与
的盐酸与 的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、
的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、 溶液中,水的电离程度相同
C . 25℃时,
溶液中,水的电离程度相同
C . 25℃时, 的HA溶液中
的HA溶液中 , 则该溶液中由水电离出的
, 则该溶液中由水电离出的 D . 在饱和AgCl、AgBr的混合溶液中加入少量
D . 在饱和AgCl、AgBr的混合溶液中加入少量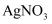 溶液,
溶液, 增大
增大
25℃时,下列说法错误的是( )
A . 中和等体积pH相等的盐酸和醋酸溶液,醋酸需要的氢氧化钠多
B . pH=3的酸HA和pH=11的碱MOH等体积混合后呈酸性,则HA为强酸
C . pH=12的NaOH溶液加水稀释10倍,水电离的c(H+)=1×10-11mol·L-1
D . pH相等的盐酸和醋酸溶液等体积混合,混合液中c(Cl-)=c(CH3COO-)
最近更新



