水的电离 知识点题库
等物质的量浓度的下列五种溶液:①CH3COOH ②(NH4)2CO3③NaHSO4 ④Ba(OH)2 , 溶液中水的电离程度由大到小排列是( )
A . ②>①>③>④
B . ①>③>④>②
C . ②>③>①>④
D . ②>③>④>①
下列粒子中,不会破坏水的电离平衡的是( )
A . OH﹣
B . Cu2+
C . S2﹣
D . Na+
下列操作中,能使电离平衡H2O⇌H++OH﹣ , 向右移动且溶液呈酸性的是( )
A . 向水中加入NaHSO4溶液
B . 向水中加入Al2(SO4)3溶液
C . 向水中加入NaOH溶液
D . 将水加热到100℃,使pH=6
25℃时,水的电离达到平衡:H2O⇌H++OH-△H>0,下列叙述正确的是( )
A . 向平衡体系中加入水,平衡正向移动,c (H+)增大
B . 将水加热,Kw增大,pH不变
C . 向水中加入少量硫酸氢钠固体, 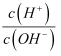 增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
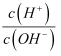 增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
增大
D . 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
回答下列问题:
-
(1) 25 ℃时,pH=3的盐酸中由水电离出的c(H+)是pH=5的盐酸中由水电离的c(H+)的倍。
-
(2) 25 ℃时,某溶液由水电离出的c(H+)=1×10-12mol·L-1 , 则该溶液的pH可能为。
-
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=,水电离出的c(H+)=,溶液中c(Na+)(填“>”“=”或“<”)c(SO42-)。
-
(4) 25 ℃时,将amol·L-1的氨水与0.01 mol·L-1盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显(填“酸”“碱”或“中”)性。
-
(5) 25 ℃时,pH=3的醋酸和pH=11的NaOH溶液等体积混合后,溶液呈(填“酸”“中”或“碱”)性,溶液中c(Na+)(填“>”“=”或“<”)c(CH3COO-)。
下列说法中正确的是( )
A . 水是极弱的电解质,它能微弱电离生成 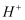 ,所以严格地说纯水呈微酸性
B . 向水中加入稀氨水,平衡逆向移动,
,所以严格地说纯水呈微酸性
B . 向水中加入稀氨水,平衡逆向移动,  降低
C .
降低
C .  ℃纯水中
℃纯水中  ,稀酸和稀碱中
,稀酸和稀碱中  D .
D .  是吸热过程,所以温度升高,平衡向电离方向移动,
是吸热过程,所以温度升高,平衡向电离方向移动,  随之增大
随之增大
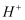 ,所以严格地说纯水呈微酸性
B . 向水中加入稀氨水,平衡逆向移动,
,所以严格地说纯水呈微酸性
B . 向水中加入稀氨水,平衡逆向移动,  降低
C .
降低
C .  ℃纯水中
℃纯水中  ,稀酸和稀碱中
,稀酸和稀碱中  D .
D .  是吸热过程,所以温度升高,平衡向电离方向移动,
是吸热过程,所以温度升高,平衡向电离方向移动,  随之增大
随之增大
已知水中存在如下平衡:H2O+H2O⇌H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液呈酸性,选择的方法是( )
A . 加热水至100℃[其中c(H+)=1×10-6mol/L]
B . 向水中加入NaHSO4
C . 向水中加入Cu(NO3)2
D . 在水中加入Na2SO3
已知如下表数据(25℃):
|
物质 |
CH3COOH |
NH3·H2O |
HCN |
H2CO3 |
|
电离常数(K) |
1.7×10-5 |
1.7×10-5 |
4.9×10-10 |
K1=4.3×10-7 K2=5.6×10-11 |
-
(1) 25℃时,将等体积等浓度的醋酸和氨水混合,混合溶液的pH7(填“>”、“=或“<);该混合溶液中水的电离会受到(填“促进”、“抑制”、“既不促进也不抑制”)。
-
(2) NaCN溶液呈性,用离子方程式解释原因。
-
(3) 写出泡沫灭火器原理(离子方程式)
-
(4) 现有浓度为0.02mol/L的HCN溶液与0.01mol/LNaOH溶液等体积混合之后(忽略混合过程中溶液体积的改变),测得c(Na+)>c(CN-),下列关系正确的是(________)A . c(H+)>c(OH-) B . c(HCN)>c(CN-) C . c(H+)+c(HCN)=c(OH-)+c(CN-) D . c(HCN)+c(CN-)=0.01mol/L
室温下,有pH=10的Na2CO3溶液、pH=10的NaOH溶液和pH=4的CH3COOH溶液。若上述三种溶液中水的电离度分别为a1、a2、a3 , 下列关系正确的是( )
A . a1=a2=a3
B . a1>a2>a3
C . a1>a2=a3
D . a1=a2<a3
向20mL0.5mol•L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是( )

A . 醋酸的电离平衡常数:B点>A点
B . 由水电离出的c(OH-):B点>C点
C . 从B点到C点,混合溶液中可能存在:c(CH3COO-)=c(Na+)
D . 从B点到C点混合溶液中一直存在:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
已知常温下,向20mL0.1mol·L-1的HA溶液中,滴入0.1mol·L-1的NaOH溶液,所得滴定曲线如下图所示,下列说法错误的是( )

A . 若A点的pH=3,则HA为一元弱酸,其电离平衡常数的数量级为10-5
B . B点各微粒物质的量浓度的关系是:2c(H+)+c(A-)=2c(OH-)+c(HA)
C . C点存在关系式:c(A-)=c(Na+)
D . 若D点的pH=8.4,则水电离出的c(H+)=10-8.4mol·L-1
常温下,下列说法错误的是( )
A . pH均为5的稀盐酸和NH4Cl溶液,由水电离的H+浓度之比为1:104
B . 向水中加入少量NaHSO4固体,c(H+)增大,Kw不变
C . 等物质的量浓度的HCOONa和NaF溶液,前者pH较大,则可发生反应:HCOOH+NaF=HF+HCOONa
D . 等物质的量浓度等体积的CH3COOH和CH3COONa溶液混合后pH约为4.7,则混合液中c(CH3COO-)>c(Na-)>c(H+)>c(OH-)
二元酸(H2A)溶液中物种浓度的负对数pc(X)与溶液pH的关系如图所示,下列说法错误的是( )

A . 图中均是常温时的数据
B . pKa1(H2A)=6.3,pKa2(H2A)=10.3
C . 溶液中可能存在:c(H+)=2c(A2-)+c(HA-)+c(OH-)
D . pH=8的溶液中:c(A2-)>c(H2A)>c(HA-)
常温下用0.2mol·L-1NaOH溶液分别滴定0.2mol·L-1一元酸HA和HB,混合溶液的pH与离子浓度变化的关系如图所示。下列有关叙述错误的是( )

A . Ka(HA)的数量级为10-5
B . 酸碱恰好反应时,HB溶液中的pH为9.15
C . 反应HA+B-=HB+A-的平衡常数为10-1.5
D . 相同条件下对水的电离影响程度:NaA>NaB
下列说法正确的是( )
A . 25℃,向蒸馏水中加入NaCl、NH4Cl、CH3COONa均能促进水的电离
B . 物质燃烧放出的热量就是该物质的燃烧热
C . 等质量的锌粒分别投入到过量等pH等体积的盐酸、醋酸中,醋酸中的平均反应速率快
D . 电解质溶液导电的过程就是其电离的过程
对下列事实的解释合理的是( )
选项 | 事实 | 解释 |
A | Mg与水的反应比Al与水的反应速率大 | 第一电离能:Mg |
B | 1mL 1×10-6mol/L醋酸稀释至1000mL,所得溶液pH仍不大于7 | 由于醋酸为弱酸 |
C | 在100℃时的纯水pH约为6 | 较常温时,水的电离平衡右移,使c(H+)约为10-6mol/L |
D | 向水中滴入少量NH4Cl溶液,可使c(H+)增大 | 由于Kw增大 |
A . A
B . B
C . C
D . D
下列粒子对水的电离没有影响的是( )
A . CH3COOH
B .  C . M-:1s22s22p6
D .
C . M-:1s22s22p6
D . 
 C . M-:1s22s22p6
D .
C . M-:1s22s22p6
D . 
将K2SO4溶液从常温加热至90℃,下列叙述正确的是( )
A . 水的离子积变大、pH变小、呈酸性
B . 水的离子积不变、pH不变、呈中性
C . 水的离子积变小、pH变大、呈碱性
D . 水的离子积变大、pH变小、呈中性
丙酮酸(CH3COCOOH)是一元弱酸。298K时,向20mL0.1mol·L-1丙酮酸溶液中滴加pH=13的NaOH溶液,溶液中lg 与pH的关系曲线如图所示。下列说法不正确的是( )
与pH的关系曲线如图所示。下列说法不正确的是( )
 与pH的关系曲线如图所示。下列说法不正确的是( )
与pH的关系曲线如图所示。下列说法不正确的是( )
A . E点溶液中,a=2
B . 298K时,CH3COCOOH的电离常数的数量级为10-3
C . G点对应的NaOH溶液的体积为20mL
D . E,F,G三点对应的溶液中水的电离程度:E<F<G
下列叙述正确的是( )
A . NaHCO3的电离方程式为 B . pH=11的氨水溶液稀释10倍后pH=10
C . NaOH溶液中通入CO2气体至过量,水的电离程度先增大后减小
D . 升高温度,NaOH溶液的pH不变
B . pH=11的氨水溶液稀释10倍后pH=10
C . NaOH溶液中通入CO2气体至过量,水的电离程度先增大后减小
D . 升高温度,NaOH溶液的pH不变
 B . pH=11的氨水溶液稀释10倍后pH=10
C . NaOH溶液中通入CO2气体至过量,水的电离程度先增大后减小
D . 升高温度,NaOH溶液的pH不变
B . pH=11的氨水溶液稀释10倍后pH=10
C . NaOH溶液中通入CO2气体至过量,水的电离程度先增大后减小
D . 升高温度,NaOH溶液的pH不变
最近更新



