еҺҹеӯҗз»“жһ„зҡ„жһ„йҖ еҺҹзҗҶ зҹҘиҜҶзӮ№йўҳеә“
 )иғҪй«ҳж•ҲеӮ¬еҢ–йҶӢй…ёй…җе’ҢзЈәиғәзҡ„еҸҚеә”гҖӮ
)иғҪй«ҳж•ҲеӮ¬еҢ–йҶӢй…ёй…җе’ҢзЈәиғәзҡ„еҸҚеә”гҖӮII.й’ҷй’ӣзҹҝеҲ¶дҪңзҡ„дёҖз§Қж–°жқҗж–ҷжҺЁиҝӣдәҶдәәе·Ҙе…үеҗҲдҪңз”Ёзҡ„иҝӣзЁӢгҖӮ
иҜ·еӣһзӯ”д»ҘдёӢй—®йўҳпјҡ
-
пјҲ1пјү еҹәжҖҒй’ӣеҺҹеӯҗзҡ„д»·з”өеӯҗжҺ’еёғејҸдёәгҖӮ
-
пјҲ2пјү в‘ жһ„жҲҗ4 вҖ”дәҢз”Іж°ЁеҹәеҗЎе•¶еҲҶеӯҗзҡ„еҗ„еҺҹеӯҗз”өиҙҹжҖ§з”ұеӨ§еҲ°е°Ҹзҡ„йЎәеәҸдёәпјҢе…¶дёӯе…ғзҙ 第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„жҳҜгҖӮ
в‘Ў1mol4вҖ”дәҢз”Іж°ЁеҹәеҗЎе•¶еҲҶеӯҗдёӯжүҖеҗ«Пғй”®зҡ„ж•°зӣ®дёәпјҢе…¶дёӯCеҺҹеӯҗзҡ„жқӮеҢ–еҪўејҸдёәгҖӮ
-
пјҲ3пјү д№ҷй…°ж°Ҝ(CH3COCl)е’Ңд№ҷй…ёй’ (CH3COONa)еҸҚеә”еҸҜд»ҘеҲ¶еӨҮйҶӢй…ёй…җгҖӮиҝҷдёӨз§ҚеҸҚеә”зү©дёӯзҶ”зӮ№жӣҙй«ҳзҡ„жҳҜпјҢеҺҹеӣ жҳҜгҖӮ
-
пјҲ4пјү иҮӘ然з•ҢдёӯйҷӨй’ҷй’ӣзҹҝеӨ–пјҢзўій…ёй’ҷгҖҒзЎ«й…ёй’ҷд№ҹйғҪжҳҜй’ҷе…ғзҙ еҪўжҲҗзҡ„еёёи§Ғзү©иҙЁгҖӮиҜ·жҜ”иҫғй”®и§’зҡ„еӨ§е°ҸпјҡCO32-SO42-(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ)пјҢжҺЁж–ӯдҫқжҚ®жҳҜгҖӮ
-
пјҲ5пјү й’ҷй’ӣзҹҝжңүеӨҡз§Қжҷ¶иғһз»“жһ„пјҢе…¶дёӯдёҖз§Қжҷ¶иғһз»“жһ„еҰӮеӣҫжүҖзӨә

в‘ жӯӨй’ҷй’ӣзҹҝжҷ¶иғһдёӯпјҢCa2+е‘Ёеӣҙи·қзҰ»жңҖиҝ‘дё”зӣёзӯүзҡ„Ca2+дёӘж•°дёәгҖӮ
в‘Ўе·ІзҹҘиҜҘжҷ¶иғһзҡ„еҜҶеәҰдёәd g/cm3 пјҢ NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮи®Ўз®—жҷ¶иғһеҸӮж•°a=pmгҖӮ(еҶҷеҮәиЎЁиҫҫејҸпјҢдёҚйңҖиҰҒиҝӣиЎҢи®Ўз®—)
 2NH3 пјҢ 2NH3+CO2
2NH3 пјҢ 2NH3+CO2  H2NCONH2+H2OгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
H2NCONH2+H2OгҖӮеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү зәізұіж°§еҢ–й“ңгҖҒзәізұіж°§еҢ–й”ҢеқҮеҸҜдҪңеҗҲжҲҗж°Ёзҡ„еӮ¬еҢ–еүӮпјҢCu2+д»·еұӮз”өеӯҗзҡ„иҪЁйҒ“иЎЁиҫҫејҸдёәпјҢZnдҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁзҡ„еҢәгҖӮ
-
пјҲ2пјү CгҖҒNгҖҒOдёүз§Қе…ғзҙ 第дёҖз”өзҰ»иғҪд»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжҳҜгҖӮ
-
пјҲ3пјү дёҠиҝ°еҢ–еӯҰж–№зЁӢејҸдёӯзҡ„ж— жңәеҢ–еҗҲзү©пјҢжІёзӮ№з”ұй«ҳеҲ°дҪҺзҡ„йЎәеәҸжҳҜпјҢеҺҹеӣ пјҡ гҖӮ
-
пјҲ4пјү е°ҝзҙ еҲҶеӯҗдёӯпјҢеҺҹеӯҗжқӮеҢ–иҪЁйҒ“зұ»еһӢжңүпјҢПғй”®дёҺПҖй”®ж•°зӣ®д№ӢжҜ”дёәгҖӮ
-
пјҲ5пјү ж°®еҢ–зЎј(BN)жҳҜдёҖз§ҚжҖ§иғҪдјҳејӮгҖҒжҪңеҠӣе·ЁеӨ§зҡ„ж–°еһӢжқҗж–ҷпјҢдё»иҰҒз»“жһ„жңүз«Ӣж–№ж°®еҢ–зЎј(еҰӮеӣҫ1) е’Ңе…ӯж–№ж°®еҢ–зЎј(еҰӮеӣҫ2)пјҢеүҚиҖ…зұ»дјјдәҺйҮ‘еҲҡзҹіпјҢеҗҺиҖ…дёҺзҹіеўЁзӣёдјјгҖӮ

в‘ жҷ¶иғһдёӯзҡ„еҺҹеӯҗеқҗж ҮеҸӮж•°еҸҜиЎЁдә“жҷ¶иғһеҶ…йғЁеҗ„еҺҹеӯҗзҡ„зӣёеҜ№дҪҚзҪ®гҖӮеӣҫ1дёӯеҺҹеӯҗеқҗж ҮеҸӮж•°Aдёә(0пјҢ0пјҢ0)пјҢDдёә(
 )пјҢеҲҷEеҺҹеӯҗзҡ„еқҗж ҮеҸӮж•°дёәгҖӮX-е°„зәҝиЎҚе°„е®һйӘҢжөӢеҫ—з«Ӣж–№ж°®еҢ–зЎјжҷ¶иғһеҸӮж•°дёә361.5pmпјҢеҲҷз«Ӣж–№ж°®еҢ–зЎјжҷ¶дҪ“N дёҺBзҡ„еҺҹеӯҗеҚҠеҫ„д№Ӣе’ҢдёәpmгҖӮпјҲ
)пјҢеҲҷEеҺҹеӯҗзҡ„еқҗж ҮеҸӮж•°дёәгҖӮX-е°„зәҝиЎҚе°„е®һйӘҢжөӢеҫ—з«Ӣж–№ж°®еҢ–зЎјжҷ¶иғһеҸӮж•°дёә361.5pmпјҢеҲҷз«Ӣж–№ж°®еҢ–зЎјжҷ¶дҪ“N дёҺBзҡ„еҺҹеӯҗеҚҠеҫ„д№Ӣе’ҢдёәpmгҖӮпјҲ 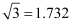 пјү
пјүв‘Ўе·ІзҹҘе…ӯж–№ж°®еҢ–зЎјеҗҢеұӮдёӯB-Nи·қзҰ»дёәacmпјҢеҜҶеәҰдёәdg/cm3 пјҢ еҲҷеұӮдёҺеұӮд№Ӣй—ҙи·қзҰ»зҡ„и®Ўз®—иЎЁиҫҫејҸдёәpmгҖӮ
-
пјҲ1пјү AгҖҒBгҖҒC дёүз§Қе…ғзҙ дёӯ第дёҖз”өзҰ»иғҪжңҖе°Ҹзҡ„е…ғзҙ жҳҜ (еЎ«е…ғзҙ з¬ҰеҸ·)пјҢе…¶еҹәжҖҒеҺҹеӯҗж ёеӨ–з”өеӯҗжҺ’еёғдёәгҖӮ
-
пјҲ2пјү Cе…ғзҙ зҡ„еҚ•иҙЁеҸҜдёҺCl2еҸҚеә”з”ҹжҲҗCCl3 пјҢ иҜҘеҲҶеӯҗдёәз»“жһ„пјҢжҳҜ(еЎ«вҖңжһҒжҖ§еҲҶеӯҗвҖқвҖңйқһжһҒжҖ§еҲҶеӯҗвҖқ)пјҢдёҺж°ҙеҸҚеә”еү§зғҲдә§з”ҹвҖңзҷҪзғҹвҖқпјҢе…¶ж–№зЁӢејҸдёәгҖӮ
-
пјҲ3пјү AгҖҒBдёӨз§Қе…ғзҙ еҸҜеҪўжҲҗеҢ–еҗҲзү©XпјҢеҶҷеҮәXзҡ„з”өеӯҗејҸгҖӮ
-
пјҲ4пјү AгҖҒCдёӨз§Қе…ғзҙ еҸҜеҪўжҲҗеҢ–еҗҲзү©Y(C2A6)пјҢе…¶дёӯеҝғеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёәгҖӮ
-
пјҲ5пјү AгҖҒ.BгҖҒCдёүз§Қе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©Z(еҲҶеӯҗејҸдёәBCA4)пјҢиҜҘзү©иҙЁжӣҫдҪңдёәдёҖз§ҚиҝҳеҺҹеүӮпјҢиҝҷжҳҜз”ұдәҺA зҡ„д»·жҖҒдёәгҖӮ
-
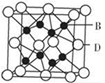
пјҲ6пјү ZеҪўжҲҗзҡ„жҷ¶дҪ“еұһдәҺз«Ӣж–№жҷ¶зі»пјҢжҷ¶иғһеҸӮж•°дёәapmпјҢе…¶жҷ¶дҪ“зұ»еһӢдёәпјҢжҷ¶иғһеҰӮдёӢеӣҫжүҖзӨә(еӣҫдёӯAеҺҹеӯҗиў«зңҒз•Ҙ)пјҢеңЁжӯӨжҷ¶иғһдёӯпјҢеҗ«жңүдёӘBеҺҹеӯҗгҖӮжҷ¶иғһеҜҶеәҰиЎЁиҫҫејҸдёә gВ·cm-3 (з”Ёaе’ҢNAиЎЁзӨә)гҖӮ

|
е…ғзҙ |
зӣёе…ідҝЎжҒҜ |
|
A |
AеҺҹеӯҗзҡ„1sиҪЁйҒ“дёҠеҸӘжңү1дёӘз”өеӯҗ |
|
B |
BжҳҜз”өиҙҹжҖ§жңҖеӨ§зҡ„е…ғзҙ |
|
C |
CеҹәжҖҒеҺҹеӯҗзҡ„2pиҪЁйҒ“дёӯжңү3дёӘжңӘжҲҗеҜ№з”өеӯҗ |
|
D |
DжҳҜдё»ж—Ҹе…ғзҙ дё”дёҺEеҗҢе‘ЁжңҹпјҢе…¶жңҖеӨ–иғҪеұӮдёҠжңү2дёӘиҝҗеҠЁзҠ¶жҖҒдёҚеҗҢзҡ„з”өеӯҗ |
|
E |
EиғҪеҪўжҲҗзәўиүІ(жҲ–з –зәўиүІ)зҡ„E2Oе’Ңй»‘иүІзҡ„EOдёӨз§Қж°§еҢ–зү© |
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү еҶҷеҮәEе…ғзҙ еҺҹеӯҗеҹәжҖҒж—¶зҡ„з”өеӯҗжҺ’еёғејҸгҖӮ
-
пјҲ2пјү Cе…ғзҙ зҡ„第дёҖз”өзҰ»иғҪжҜ”ж°§е…ғзҙ зҡ„第дёҖз”өзҰ»иғҪ (еЎ«вҖңеӨ§вҖқжҲ–вҖңе°ҸвҖқ) гҖӮ
-
пјҲ3пјү CA3еҲҶеӯҗдёӯCеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢжҳҜгҖӮ
-
пјҲ4пјү AгҖҒCгҖҒEдёүз§Қе…ғзҙ еҸҜеҪўжҲҗ[E(CA3)4]2+ пјҢ е…¶дёӯеӯҳеңЁзҡ„еҢ–еӯҰй”®зұ»еһӢжңү(еЎ«еәҸеҸ·)пјӣ
в‘ й…ҚдҪҚй”® в‘ЎйҮ‘еұһй”® в‘ўжһҒжҖ§е…ұд»·й”® в‘ЈйқһжһҒжҖ§е…ұд»·й”® в‘ӨзҰ»еӯҗй”® в‘Ҙж°ўй”®
иӢҘ[E(CA3)4]2+е…·жңүеҜ№з§°зҡ„з©әй—ҙжһ„еһӢпјҢдё”еҪ“[E(CA3)4]2+дёӯзҡ„дёӨдёӘCA3иў«дёӨдёӘClвҲ’еҸ–д»Јж—¶пјҢиғҪеҫ—еҲ°дёӨз§ҚдёҚеҗҢз»“жһ„зҡ„дә§зү©пјҢеҲҷ[E(CA3)4]2+зҡ„з©әй—ҙжһ„еһӢдёә (еЎ«еәҸеҸ·)гҖӮ
a.е№ійқўжӯЈж–№еҪў
b.жӯЈеӣӣйқўдҪ“
c.дёүи§’й”ҘеҪў
d.VеҪў
-
пјҲ5пјү BдёҺDеҸҜеҪўжҲҗзҰ»еӯҗеҢ–еҗҲзү©пјҢе…¶жҷ¶иғһз»“жһ„еҰӮеӣҫжүҖзӨәпјҢе…¶дёӯDзҰ»еӯҗзҡ„й…ҚдҪҚж•°дёәпјҢиӢҘиҜҘжҷ¶дҪ“зҡ„еҜҶеәҰдёәa gВ·cmвҲ’3 пјҢ еҲҷиҜҘжҷ¶иғһзҡ„дҪ“з§ҜжҳҜcm3(еҶҷеҮәиЎЁиҫҫејҸеҚіеҸҜ)гҖӮ
й’ҙзҡ„еҗҲйҮ‘еҸҠе…¶й…ҚеҗҲзү©з”ЁйҖ”йқһеёёе№ҝжіӣгҖӮе·ІзҹҘCo3+жҜ”Fe3+зҡ„ж°§еҢ–жҖ§жӣҙејәпјҢеңЁж°ҙжә¶ж¶ІдёӯдёҚиғҪеӨ§йҮҸеӯҳеңЁгҖӮ
-
пјҲ1пјү Co3+зҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸдёәгҖӮ
-
пјҲ2пјү ж— ж°ҙCoCl2зҡ„зҶ”зӮ№дёә735в„ғгҖҒжІёзӮ№дёә1049в„ғпјҢFeCl3зҶ”зӮ№дёә306в„ғгҖҒжІёзӮ№дёә315в„ғгҖӮCoCl2еұһдәҺжҷ¶дҪ“пјҢFeCl3еұһдәҺ жҷ¶дҪ“гҖӮ
-
пјҲ3пјү BNCPеҸҜз”ЁдәҺжҝҖе…үиө·зҲҶеҷЁзӯүпјҢеҸҜз”ұHClO4гҖҒCTCNгҖҒNaNTе…ұеҸҚеә”еҲ¶еӨҮгҖӮ
в‘ Cl
 зҡ„з©әй—ҙжһ„еһӢдёә.
зҡ„з©әй—ҙжһ„еһӢдёә.в‘ЎCTCNзҡ„еҢ–еӯҰејҸдёә[COпјҲNH3пјү4CO3]NO3 пјҢ дёҺCoпјҲв…ў)еҪўжҲҗй…ҚдҪҚй”®зҡ„еҺҹеӯҗжҳҜ(е·ІзҹҘC
 зҡ„з»“жһ„ејҸдёә
зҡ„з»“жһ„ејҸдёә  )гҖӮ
)гҖӮв‘ўNaNTеҸҜд»Ҙ
 (еҸҢиҒҡж°°иғәпјүдёәеҺҹж–ҷеҲ¶еӨҮгҖӮ1molеҸҢиҒҡж°°иғәеҲҶеӯҗдёӯеҗ«Пғй”®зҡ„ж•°зӣ®дёә.
(еҸҢиҒҡж°°иғәпјүдёәеҺҹж–ҷеҲ¶еӨҮгҖӮ1molеҸҢиҒҡж°°иғәеҲҶеӯҗдёӯеҗ«Пғй”®зҡ„ж•°зӣ®дёә. -
пјҲ4пјү CoдёҺCOдҪңз”ЁеҸҜз”ҹжҲҗCo2пјҲCO)8 пјҢ е…¶з»“жһ„еҰӮеӣҫ1жүҖзӨәгҖӮиҜҘеҲҶеӯҗдёӯCеҺҹеӯҗзҡ„жқӮеҢ–ж–№ејҸдёә гҖӮ
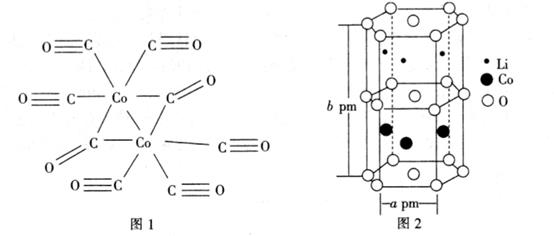
-
пјҲ5пјү й’ҙй…ёй”ӮжҳҜеёёи§Ғй”Ӯз”өжұ зҡ„з”өжһҒжқҗж–ҷпјҢе…¶жҷ¶иғһз»“жһ„еҰӮеӣҫ2жүҖзӨәгҖӮиҜҘжҷ¶иғһдёӯж°§еҺҹеӯҗзҡ„ж•°зӣ®дёәгҖӮе·ІзҹҘNAзҡ„йҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢеҲҷиҜҘжҷ¶иғһзҡ„еҜҶеәҰдёәпјҲз”Ёеҗ«aгҖҒbгҖҒNAзҡ„д»Јж•°ејҸиЎЁзӨәпјүgВ·cm-3гҖӮ
-
пјҲ1пјү еҹәжҖҒPеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸдёәпјҢжңүдёӘжңӘжҲҗеҜ№з”өеӯҗгҖӮ
-
пјҲ2пјү еёёжё©дёӢPCl5жҳҜдёҖз§ҚзҷҪиүІжҷ¶дҪ“пјҢе…¶з«Ӣж–№жҷ¶зі»жҷ¶дҪ“з»“жһ„жЁЎеһӢеҰӮеӣҫз”ІжүҖзӨәпјҢз”ұAгҖҒBдёӨз§Қеҫ®зІ’жһ„жҲҗгҖӮе°Ҷе…¶еҠ зғӯиҮі148в„ғзҶ”еҢ–пјҢеҪўжҲҗдёҖз§ҚиғҪеҜјз”өзҡ„зҶ”дҪ“гҖӮе·ІзҹҘAгҖҒBдёӨз§Қеҫ®зІ’еҲҶеҲ«дёҺCCl4гҖҒSF6дә’дёәзӯүз”өеӯҗдҪ“пјҢеҲҷAдёәпјҢе…¶дёӯеҝғеҺҹеӯҗжқӮеҢ–иҪЁйҒ“зұ»еһӢдёәпјҢBдёәгҖӮ
-
пјҲ3пјү PO43-зҡ„з©әй—ҙжһ„еһӢдёәпјҢе…¶зӯүз”өеӯҗдҪ“жңүпјҲиҜ·еҶҷеҮәдёҖз§ҚпјүгҖӮ
-
пјҲ4пјү з ·еҢ–й•“еұһдәҺ第дёүд»ЈеҚҠеҜјдҪ“пјҢе®ғиғҪзӣҙжҺҘе°Ҷз”өиғҪиҪ¬еҸҳдёәе…үиғҪпјҢз ·еҢ–й•“зҒҜжіЎеҜҝе‘ҪжҳҜжҷ®йҖҡзҒҜжіЎзҡ„100еҖҚпјҢиҖҢиҖ—иғҪеҸӘжңүе…¶10%гҖӮжҺЁе№ҝз ·еҢ–й•“зӯүеҸ‘е…үдәҢжһҒз®Ў(LED)з…§жҳҺпјҢжҳҜиҠӮиғҪеҮҸжҺ’зҡ„жңүж•ҲдёҫжҺӘгҖӮе·ІзҹҘз ·еҢ–й•“зҡ„жҷ¶иғһз»“жһ„еҰӮеӣҫд№ҷпјҢжҷ¶иғһеҸӮж•°a= 565pmгҖӮ

в‘ з ·еҢ–й•“зҡ„еҢ–еӯҰејҸдёәпјҢй•“еҺҹеӯҗзҡ„й…ҚдҪҚж•°дёәгҖӮ
в‘Ўз ·еҢ–й•“зҡ„жҷ¶иғһеҜҶеәҰ=g/cm3пјҲеҲ—ејҸ并计算пјҢзІҫзЎ®еҲ°е°Ҹж•°зӮ№еҗҺдёӨдҪҚпјүпјҢmдҪҚзҪ®GaеҺҹеӯҗдёҺnдҪҚзҪ®AsеҺҹеӯҗд№Ӣй—ҙзҡ„и·қзҰ»дёәpm(еҲ—ејҸиЎЁзӨә)гҖӮ
-
пјҲ1пјү CеҺҹеӯҗзҡ„д»·з”өеӯҗиҪЁйҒ“иЎЁиҫҫејҸдёәпјҢзўіе…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯеҢәпјҢе®ғжүҖеңЁзҡ„е‘ЁжңҹпјҢ第дёҖз”өзҰ»иғҪжңҖеӨ§зҡ„е…ғзҙ жҳҜгҖӮ
-
пјҲ2пјү
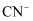 е’ҢN2жҳҜзӯүз”өеӯҗдҪ“пјҢ
е’ҢN2жҳҜзӯүз”өеӯҗдҪ“пјҢ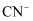 зҡ„з”өеӯҗејҸдёәгҖӮ
зҡ„з”өеӯҗејҸдёәгҖӮ
-
пјҲ3пјү C60е’ҢйҮ‘еҲҡзҹідә’дёәеҗҢзҙ ејӮеҪўдҪ“пјҢзҶ”зӮ№иҫғй«ҳиҖ…дёәпјҢе…¶еҺҹеӣ жҳҜгҖӮ
-
пјҲ4пјү дёҷзғҜйҶҮзҡ„з»“жһ„з®ҖејҸдёә
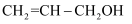 пјҢ е…¶дёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢдёәпјҢПғй”®е’ҢПҖй”®зҡ„дёӘж•°жҜ”дёәгҖӮ
пјҢ е…¶дёӯзўіеҺҹеӯҗзҡ„жқӮеҢ–зұ»еһӢдёәпјҢПғй”®е’ҢПҖй”®зҡ„дёӘж•°жҜ”дёәгҖӮ

дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
 B . Y2-дёҺNa+зҡ„еҚҠеҫ„еӨ§е°Ҹе…ізі»дёәY2->Na+
C . Yзҡ„第дёҖз”өзҰ»иғҪеӨ§дәҺXзҡ„第дёҖз”өзҰ»иғҪ
D . з”өиҙҹжҖ§жңҖеӨ§зҡ„е…ғзҙ дёәJ
B . Y2-дёҺNa+зҡ„еҚҠеҫ„еӨ§е°Ҹе…ізі»дёәY2->Na+
C . Yзҡ„第дёҖз”өзҰ»иғҪеӨ§дәҺXзҡ„第дёҖз”өзҰ»иғҪ
D . з”өиҙҹжҖ§жңҖеӨ§зҡ„е…ғзҙ дёәJ
-
пјҲ1пјү еҹәжҖҒй’ӣеҺҹеӯҗзҡ„ж ёеӨ–з”өеӯҗжҺ’еёғејҸдёәгҖӮ
-
пјҲ2пјү еҺҹеӯҗдёӯиҝҗеҠЁзҡ„з”өеӯҗжңүдёӨз§ҚзӣёеҸҚзҡ„иҮӘж—ӢзҠ¶жҖҒпјҢиӢҘдёҖз§ҚиҮӘж—ӢзҠ¶жҖҒз”Ё+
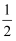 иЎЁзӨәпјҢдёҺд№ӢзӣёеҸҚзҡ„еҲҷз”Ё-
иЎЁзӨәпјҢдёҺд№ӢзӣёеҸҚзҡ„еҲҷз”Ё-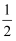 иЎЁзӨәпјҢз§°дёәз”өеӯҗзҡ„иҮӘж—ӢзЈҒйҮҸеӯҗж•°гҖӮеҜ№дәҺеҹәжҖҒй’ӣеҺҹеӯҗпјҢе…¶д»·з”өеӯҗиҮӘж—ӢзЈҒйҮҸеӯҗж•°зҡ„д»Јж•°е’ҢдёәгҖӮ
иЎЁзӨәпјҢз§°дёәз”өеӯҗзҡ„иҮӘж—ӢзЈҒйҮҸеӯҗж•°гҖӮеҜ№дәҺеҹәжҖҒй’ӣеҺҹеӯҗпјҢе…¶д»·з”өеӯҗиҮӘж—ӢзЈҒйҮҸеӯҗж•°зҡ„д»Јж•°е’ҢдёәгҖӮ
-
пјҲ3пјү еҰӮеӣҫжүҖзӨәзҡ„жҷ¶дҪ“з»“жһ„жҳҜдёҖз§ҚеҹәзЎҖж— жңәд»Ӣз”өжқҗж–ҷзҡ„жңҖе°Ҹз»“жһ„еҚ•е…ғ(жҷ¶иғһ)пјҢиҝҷз§Қжҷ¶дҪ“жқҗж–ҷзҡ„еҢ–еӯҰејҸдёәгҖӮ

-
пјҲ4пјү жҲ‘еӣҪ科еӯҰ家用Mg3N2е’ҢTiCl4еҲ¶еӨҮи¶…еҜјжқҗж–ҷTiNпјҢзҗҶи®әеҲҶжһҗеҸҜиғҪзҡ„еҸҚеә”дёәпјҡ
Mg3N2+2TiCl4=2TiN+3MgCl2+Cl2вҶ‘ в…
4Mg3N2+6TiCl4=6TiN+12MgCl2+N2вҶ‘ в…Ў
е·ІзҹҘпјҡв…°.йғЁеҲҶзү©иҙЁзҡ„зҶ”жІёзӮ№
Mg3N2
TiCl4
MgCl2
TiN
зҶ”зӮ№/в„ғ
800(еҲҶи§Ј)
-25
714
2950
жІёзӮ№/в„ғ
700(еҚҮеҚҺ)
136.4
1412
(з•Ҙ)
в…ұ.TiCl4иғҪе’ҢNaOHжә¶ж¶ІеҸҚеә”гҖӮ
еҲ¶еӨҮTiNзҡ„е…ій”®жӯҘйӘӨеҰӮдёӢпјҡ600в„ғж—¶пјҢе°ҶTiCl4жҢү0.2L/minзҡ„йҖҹзҺҮйҖҡе…ҘзӣӣжңүMg3N2зҡ„еҲҡзҺүеқ©еҹҡеҶ…пјҢеҪ“TiCl4йҖӮеҪ“иҝҮйҮҸеҗҺеҒңжӯўйҖҡе…ҘпјҢеңЁN2дёӯеҶ·еҚҙиҮіе®Өжё©гҖӮ
科еӯҰ家йҖҡиҝҮжөӢе®ҡдёҚеҗҢж—¶й—ҙж®өе°ҫж°”еӨ„зҗҶиЈ…зҪ®дёӯй’ӣе’Ңж°Ҝзҡ„иҙЁйҮҸзҷҫеҲҶеҗ«йҮҸпјҢиҝӣиҖҢзЎ®е®ҡз”ҹжҲҗTiNеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸгҖӮ

в‘ TiCl4еұһдәҺжҷ¶дҪ“гҖӮ
в‘Ўз»“еҗҲеӣҫпјҢеҲӨж–ӯеҲ¶еӨҮTiNзҡ„еҸҚеә”жҳҜвҖңв… вҖқиҝҳжҳҜвҖңв…ЎвҖқпјҢ并иҜҙжҳҺеҲӨж–ӯдҫқжҚ®гҖӮ
-
пјҲ1пјү йӮ»ж°ЁеҹәеҗЎе•¶(
 )зҡ„й“ңй…ҚеҗҲзү©еңЁжңүжңәдёҚеҜ№з§°еҗҲжҲҗдёӯиө·еӮ¬еҢ–иҜұеҜјж•Ҳеә”гҖӮйӮ»ж°ЁеҹәеҗЎе•¶дёӯжүҖжңүе…ғзҙ зҡ„з”өиҙҹжҖ§з”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёә(еЎ«е…ғзҙ з¬ҰеҸ·)гҖӮеҹәжҖҒNеҺҹеӯҗж ёеӨ–з”өеӯҗзҡ„иҝҗеҠЁзҠ¶жҖҒжңүз§ҚпјҢи®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢ1 mol
)зҡ„й“ңй…ҚеҗҲзү©еңЁжңүжңәдёҚеҜ№з§°еҗҲжҲҗдёӯиө·еӮ¬еҢ–иҜұеҜјж•Ҳеә”гҖӮйӮ»ж°ЁеҹәеҗЎе•¶дёӯжүҖжңүе…ғзҙ зҡ„з”өиҙҹжҖ§з”ұе°ҸеҲ°еӨ§зҡ„йЎәеәҸдёә(еЎ«е…ғзҙ з¬ҰеҸ·)гҖӮеҹәжҖҒNеҺҹеӯҗж ёеӨ–з”өеӯҗзҡ„иҝҗеҠЁзҠ¶жҖҒжңүз§ҚпјҢи®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢ1 mol  дёӯеҗ«жңүПғй”®зҡ„ж•°зӣ®дёәгҖӮ
дёӯеҗ«жңүПғй”®зҡ„ж•°зӣ®дёәгҖӮ
-
пјҲ2пјү SiCl4жҳҜз”ҹдә§й«ҳзәҜзЎ…зҡ„еүҚй©ұдҪ“пјҢе…¶дёӯSiйҮҮеҸ–зҡ„жқӮеҢ–зұ»еһӢдёәгҖӮSiCl4еҸҜеҸ‘з”ҹж°ҙи§ЈеҸҚеә”пјҢжңәзҗҶеҰӮдёӢпјҡ

еҗ«sгҖҒpгҖҒdиҪЁйҒ“зҡ„жқӮеҢ–зұ»еһӢжңүпјҡв‘ dsp2гҖҒв‘Ўsp3dгҖҒв‘ўsp3d2 пјҢ дёӯй—ҙдҪ“SiCl4(H2O)дёӯSiйҮҮеҸ–зҡ„жқӮеҢ–зұ»еһӢдёә (еЎ«ж ҮеҸ·)гҖӮSiCl4зҡ„зҶ”жІёзӮ№ (еЎ«вҖңй«ҳдәҺвҖқжҲ–вҖңдҪҺдәҺвҖқ)CCl4 пјҢ еҺҹеӣ жҳҜгҖӮ
-
пјҲ3пјү дёҖз§ҚйёҹеҳҢе‘Өе’ҢеҗЎе’Ҝзҡ„з»“жһ„еҰӮеӣҫгҖӮ

в‘ йёҹеҳҢе‘ӨдёӯиҪЁйҒ“д№Ӣй—ҙзҡ„еӨ№и§’вҲ 1вҲ 2(еЎ«вҖңпјһвҖқжҲ–вҖңпјңвҖқ)
в‘ЎеҲҶеӯҗдёӯзҡ„еӨ§ПҖй”®еҸҜд»Ҙз”Ёз¬ҰеҸ·ПҖ
 иЎЁзӨәпјҢе…¶дёӯmд»ЈиЎЁеҸӮдёҺеҪўжҲҗеӨ§ПҖй”®зҡ„еҺҹеӯҗж•°пјҢnд»ЈиЎЁеҸӮдёҺеҪўжҲҗеӨ§ПҖй”®зҡ„з”өеӯҗж•°гҖӮеҲҷиҜҘеҗЎе’Ҝдёӯзҡ„еӨ§ПҖй”®еҸҜиЎЁзӨәдёәгҖӮ
иЎЁзӨәпјҢе…¶дёӯmд»ЈиЎЁеҸӮдёҺеҪўжҲҗеӨ§ПҖй”®зҡ„еҺҹеӯҗж•°пјҢnд»ЈиЎЁеҸӮдёҺеҪўжҲҗеӨ§ПҖй”®зҡ„з”өеӯҗж•°гҖӮеҲҷиҜҘеҗЎе’Ҝдёӯзҡ„еӨ§ПҖй”®еҸҜиЎЁзӨәдёәгҖӮ -
пјҲ4пјү зҒ«жҳҹеІ©зҹідёӯеӯҳеңЁеӨ§йҮҸзҡ„ж°®еҢ–й•“пјҢж°®еҢ–й•“дёәе…ӯж–№жҷ¶иғһпјҢз»“жһ„еҰӮеӣҫжүҖзӨәгҖӮ

иӢҘиҜҘжҷ¶дҪ“еҜҶеәҰдёәd gВ·cm-3 пјҢ жҷ¶иғһеҸӮж•°a=bвү c(еҚ•дҪҚпјҡnm)пјҢaгҖҒbеӨ№и§’дёә120В°пјҢйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјдёәNA пјҢ еҲҷжҷ¶иғһеҸӮж•°c=nm(еҶҷеҮәд»Јж•°ејҸ)гҖӮ

-
пјҲ1пјү sз”өеӯҗзҡ„еҺҹеӯҗиҪЁйҒ“е‘ҲеҪўпјҢжҜҸдёӘsиғҪзә§жңүдёӘеҺҹеӯҗиҪЁйҒ“пјӣpз”өеӯҗзҡ„еҺҹеӯҗиҪЁйҒ“е‘ҲеҪўпјҢжҜҸдёӘpиғҪзә§жңүдёӘеҺҹеӯҗиҪЁйҒ“гҖӮ
-
пјҲ2пјү е…ғзҙ Xзҡ„еҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗжҺ’еёғејҸдёәnsnnpnпјӢ1 пјҢ еҺҹеӯҗдёӯиғҪйҮҸжңҖй«ҳзҡ„жҳҜз”өеӯҗпјҢе…¶з”өеӯҗдә‘еңЁз©әй—ҙжңүж–№еҗ‘гҖӮ
-
пјҲ3пјү дёӢеҲ—еҺҹеӯҗжҲ–зҰ»еӯҗзҡ„з”өеӯҗжҺ’еёғејҸжҲ–иҪЁйҒ“иЎЁзӨәејҸжӯЈзЎ®зҡ„жҳҜ(еЎ«еәҸеҸ·)
в‘ K+пјҡ
 в‘ЎFпјҡ
в‘ЎFпјҡ
в‘ўPпјҡ

в‘ЈCuпјҡ

в‘ӨFe2+пјҡ

в‘ҘMgпјҡ

в‘ҰOпјҡ

 пјҢ еҲҷиҜҘе…ғзҙ дҪҚдәҺе‘Ёжңҹ表第еӣӣе‘Ёжңҹ第ⅢAж—Ҹ
C .
пјҢ еҲҷиҜҘе…ғзҙ дҪҚдәҺе‘Ёжңҹ表第еӣӣе‘Ёжңҹ第ⅢAж—Ҹ
C .  иЎЁзӨә3pиғҪзә§жңү2дёӘиҪЁйҒ“
D . з„°иүІиҜ•йӘҢжҳҜдёҺеҺҹеӯҗж ёеӨ–з”өеӯҗи·ғиҝҒжңүе…ізҡ„зү©зҗҶзҺ°иұЎ
иЎЁзӨә3pиғҪзә§жңү2дёӘиҪЁйҒ“
D . з„°иүІиҜ•йӘҢжҳҜдёҺеҺҹеӯҗж ёеӨ–з”өеӯҗи·ғиҝҒжңүе…ізҡ„зү©зҗҶзҺ°иұЎ

 пјҢ з ҙеқҸдәҶдёҖдёӘж–°зҡ„иғҪеұӮ
B . е…ғзҙ BеҹәжҖҒеҺҹеӯҗдёӯеӯҳеңЁдёӨдёӘжңӘжҲҗеҜ№зҡ„з”өеӯҗ
C . е…ғзҙ CеҹәжҖҒеҺҹеӯҗзҡ„pиҪЁйҒ“дёҠжңүдёҖдёӘз”өеӯҗ
D . дёүз§Қе…ғзҙ дёӯпјҢе…ғзҙ Aзҡ„йҮ‘еұһжҖ§жңҖејә
пјҢ з ҙеқҸдәҶдёҖдёӘж–°зҡ„иғҪеұӮ
B . е…ғзҙ BеҹәжҖҒеҺҹеӯҗдёӯеӯҳеңЁдёӨдёӘжңӘжҲҗеҜ№зҡ„з”өеӯҗ
C . е…ғзҙ CеҹәжҖҒеҺҹеӯҗзҡ„pиҪЁйҒ“дёҠжңүдёҖдёӘз”өеӯҗ
D . дёүз§Қе…ғзҙ дёӯпјҢе…ғзҙ Aзҡ„йҮ‘еұһжҖ§жңҖејә



