极性分子和非极性分子 知识点题库
短周期的5种非金属元素,其中A、B、C的原子最外层电子排布可表示为:A:asa , B:bsbbpb , C:csccp2c , D与B同主族,E在C的下一周期,且是同周期元素中电负性最大的元素。回答下列问题:
-
(1) 由A、B、C、E四种元素中的两种元素可形成多种分子,下列分子①BC2、②BA4、③A2C2、④BE4 , 其中属于极性分子的是(填序号)。
-
(2) C的气态氢化物比下一周期同族元素的气态氢化物沸点还要高,其原因是。
-
(3) B、C两元素能和A元素组成两种常见的溶剂,其分子式分别为、。相同条件下DE4在前者中的溶解度(填“大于”或“小于”)在后者中的溶解度。
-
(4) BA4、BE4和DE4的沸点从高到低的顺序为(填化学式)。
-
(5) A、C、E三种元素可形成多种含氧酸,如AEC、AEC2、AEC3、AEC4等,以上列举的四种酸其酸性由强到弱的顺序为:(填化学式)。
下列物质的分子正负电荷重心不相重合的是( )
A . C2H2
B . CO2
C . NH3
D . BF3
下表为元素周期表前三周期的一部分:

-
(1) X的氢化物的沸点与W的氢化物的沸点比较:>(填化学式),原因是。
-
(2) X的基态原子的电子排布图为(填序号),另一电子排布图不能作为基态原子的电子排布图是因为它不符合。

-
(3) 以上五种元素中,(填元素符号)的第一电离能最大。
-
(4) 由以上某种元素与氢元素组成的三角锥形分子E和由以上某种元素组成的直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),反应如图所示,则下列判断错误的是 。
 A . G是最活泼的非金属单质 B . L是极性分子 C . E的中心原子的杂化轨道类型为sp2杂化 D . M的化学性质比同周期相邻元素单质的化学性质活泼 E . M分子中有1个σ键,2个π键
A . G是最活泼的非金属单质 B . L是极性分子 C . E的中心原子的杂化轨道类型为sp2杂化 D . M的化学性质比同周期相邻元素单质的化学性质活泼 E . M分子中有1个σ键,2个π键
下列叙述错误的是( )
A . 卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强
B . 以极性键结合的分子,不一定是极性分子
C . 判断A2B或AB2型分子是极性分子的依据是:具有极性键且分子构型不对称,键角小于180°,为非直线形结构
D . 非极性分子中,各原子间都应以非极性键结合
常温下三氯化氮(NCl3)是一种淡黄色的液体,其分子结构呈三角锥形,以下关于NCl3说法正确的是( )
A . 该物质中N-Cl键是非极性键
B . NCl3中N原子采用sp2杂化
C . 该物质是极性分子
D . 因N-Cl键的键能大,所以NCl3的沸点高
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )

A . 每个原子都达到8电子稳定结构
B . 分子中5个R-Cl键键能不相同
C . 键角(Cl-R-Cl)有90°、120°、180°几种
D . RCl5受热后会分解生成分子RCl3 , RCl5和RCl3都是极性分子
下列说法正确的是( )
A . 凡是中心原子采取sp3杂化的分子,其立体构型都是正四面体形
B . 白磷分子和CH4都是正四面体形分子且键角都为109°28'
C . 若ABn型分子的中心原子A上没有孤电子对,则ABn为非极性分子
D . NH3和PH3分子的VSEPR模型为正四面体形,PH3中P—H键键角大于NH3中N—H键键角
白磷(P4)易自燃,易溶于CS2 , Ca(H2PO4)2是磷肥的有效成分;砷化镓是重要的半导体材料。下列关于氮、磷、砷的单质及化合物的说法正确的是( )

A . 磷肥与草木灰混合施肥效果更佳
B . 肼的沸点为113.5℃,说明肼分子间可能存在氢键
C . 白磷分子(P4)是极性分子,白磷可保存在水中
D . 砷化镓的晶胞结构如上图所示,镓原子配位数为8
W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素与锂组成的盐是一种新型电池的电解质,其结构如图。下列说法错误的是( )

A . 电负性:W>Y>Z>X
B . Y、Z组成的分子可能为非极性分子也可能为极性分子
C . W是同周期中原子半径最大的元素
D . 阴离子中所有原子均满足8电子稳定结构
SF6可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示。有关SF6的说法正确的是( )

A . 是非极性分子
B . 键角  都等于90°
C .
都等于90°
C .  与
与 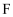 之间共用电子对偏向S
D .
之间共用电子对偏向S
D .  原子满足8电子稳定结构
原子满足8电子稳定结构
 都等于90°
C .
都等于90°
C .  与
与 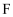 之间共用电子对偏向S
D .
之间共用电子对偏向S
D .  原子满足8电子稳定结构
原子满足8电子稳定结构
对下列实验事实的理论解释错误的( )
选项 | 实验事实 | 理论解释 |
A | 环状S8分子结构如图 | S原子采取的杂化方式为sp3 |
B | SO2易溶于水而难溶于CCl4 | SO2和水都是极性分子而CCl4为非极性分子 |
C | HF分子热稳定性比HCl强 | HF分子间作用力比HCl强 |
D | Fe2+比Fe3+的稳定性小 | Fe2+和Fe3+的价电子排布式分别为3d6、3d5 , Fe3+的3d能级为半充满的稳定结构 |
A . A
B . B
C . C
D . D
下列说法正确的是( )
A . 非极性分子中的原子上一定不含孤电子对
B . 平面三角形分子一定是非极性分子
C . 二氯甲烷(CH2Cl2)分子的中心原子采取sp3杂化,键角均为109°28'
D . ABn型分子的中心原子最外层满足8电子结构,则ABn不一定是非极性分子
有X、Y、Z、Q、T五种元素,X元素原子的M电子层的p轨道上有两个未成对电子且无空轨道;Y元素原子的价电子排布式为3d64s2 ,Z元素原子的L电子层上p轨道有一个空轨道;Q元素原子的L电子层的p轨道上只有一对成对电子;T元素原子M电子层上p轨道上有三个未成对电子。下列说法中错误的是( )
A . T元素有一种单质的空间结构为正四面体形
B . ZQ分子中含有1个σ键和2个π键
C . X元素和Q元素能形成两种只含极性键的极性分子
D . Z元素与X、Q元素均能形成直线形非极性分子
青藏铁路沿线的路基两旁插有一排排热棒,其内部为装有液氨的密闭空心长棒。在冬季,土中的热量使液氨蒸发到顶部,冷却后又液化回到下部,保持冻土冷冻状态不松软。下列说法正确的是( )

A . 液氨蒸发时破坏了分子间的氢键和共价键
B . NH3的中心原子采用sp3杂化
C . NH3是含有极性键的极性分子
D . 沸点:NH3>PH3
UO2与铀氮化物是重要的核燃料,已知:3(NH2)4[ UO2(CO3)3] 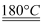 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
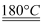 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑。回答下列问题:
-
(1) 基态氮原子价电子轨道表示式为。
-
(2) 反应所得气态化合物中属于非极性分子的是(填化学式)。
-
(3) 某种铀氮化物的晶体结构与NaCl的结构相似。NaCl的Borm-Haber循环如图甲所示。已知:元素的一个基态气态原子获得电子成为气态阴离子时所放 出的能量称为电子亲和能。下列有关说法正确的是 (填序号)。
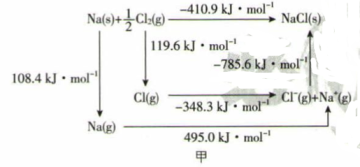
a.Cl-Cl 键的键能为119.6 kJ·mol -1
b.Na的第一电离能为603.4kJ·mol-1
c. NaCl的晶格能为785.6 kJ·mol-1
d. Cl的第一电子亲和能为348.3 kJ·mol-1
-
(4) 依据VSEPR理论推测
 的空间结构为。分子中的大π键可用符号
的空间结构为。分子中的大π键可用符号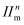 表示,其中m代表参与形成大π键的原子数,n代表参与形成大,π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大,π键的电子数(如苯分子中的大π键可表示为 ),则
),则 中的大π键应表示为 。
中的大π键应表示为 。
-
(5) UO2可用于制备UF4:2UO2 + 5NH4HF2
 2UF4·2NH4F+3NH3↑+4H2O↑,其中
2UF4·2NH4F+3NH3↑+4H2O↑,其中 的结构可表示为[F--H……F]- , 反应中断裂的化学键有(填序号)。
的结构可表示为[F--H……F]- , 反应中断裂的化学键有(填序号)。
a.氢键b. 极性键c. 离子键d. 金属键e. 非极性键
-
(6) 铀氮化物的某两种晶胞如图乙所示:
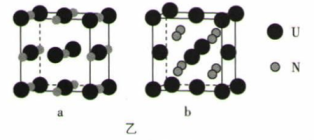
①晶胞a中铀元素的化合价为 ,与U原子距离相等且最近的U原子有个。
②已知晶体b的密度为dg·cm-1 , U原子的半径为r1cm,N原子的半径为r2cm,设NA为阿伏加德罗常数的值,则该晶胞原子的空间利用率为 (列出计算式)。
下列对分子的叙述中,错误的是( )
A . HCl、HBr、HI的熔点、沸点依次升高与分子间作用力大小有关
B .  分子的正电中心和负电中心不重合。则
分子的正电中心和负电中心不重合。则 在水中的溶解度和
在水中的溶解度和 的一样
C . 非极性分子中可能含有极性键
D .
的一样
C . 非极性分子中可能含有极性键
D . 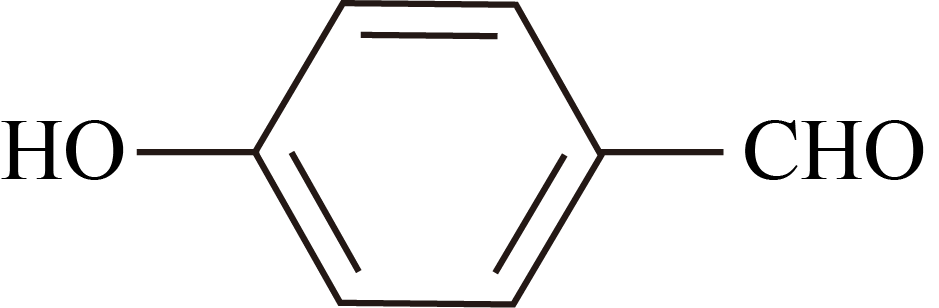 的沸点高于
的沸点高于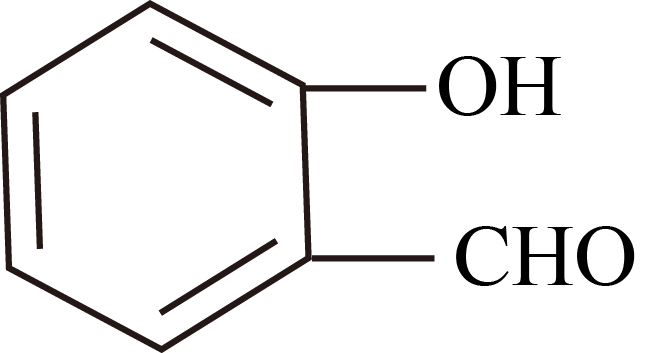
 分子的正电中心和负电中心不重合。则
分子的正电中心和负电中心不重合。则 在水中的溶解度和
在水中的溶解度和 的一样
C . 非极性分子中可能含有极性键
D .
的一样
C . 非极性分子中可能含有极性键
D .  的沸点高于
的沸点高于
氢氟酸可用于雕刻玻璃,其反应原理为4HF+SiO2=SiF4↑+2H2O。下列有关说法正确的是( )
A . HF中的共价键为s-pσ键
B . H2O、SiF4均为极性分子
C . SiO2晶体为分子晶体
D . 基态氧原子的价层电子轨道表示式为
下列说法正确的是( )
A . 由极性键构成的分子全都是极性分子
B . 含有非极性键的分子一定是非极性分子
C . 极性分子一定含有极性键,非极性分子一定含有非极性键
D . 以极性键结合的双原子分子,一定是极性分子
W、X、Y、Z是原子序数依次增大的4种短周期元素,X、Y、Z位于同一周期,XZ3与YW3之间能以配位键相结合,XY的熔点高、硬度大。下列说法正确的是( )
A . XZ3与YW3都为极性分子
B . 同周期中第一电离能小于X的元素有2种
C . 同周期中Z元素的电负性最强
D . 与Y同主族元素中,Y单质的性质最活泼
据Science报道,大气中存在一种潜在的温室气体 , 虽然其数量有限,但它是已知气体中吸热最高的气体。关于
, 虽然其数量有限,但它是已知气体中吸热最高的气体。关于 的说法正确的是( )
的说法正确的是( )
 , 虽然其数量有限,但它是已知气体中吸热最高的气体。关于
, 虽然其数量有限,但它是已知气体中吸热最高的气体。关于 的说法正确的是( )
的说法正确的是( )
A .  中最多有4个原子在一条直线上
B .
中最多有4个原子在一条直线上
B .  易燃烧生成
易燃烧生成 、
、 C .
C .  分子是含有极性键的极性分子
D .
分子是含有极性键的极性分子
D .  中硫元素的化合价为
中硫元素的化合价为 价
价
 中最多有4个原子在一条直线上
B .
中最多有4个原子在一条直线上
B .  易燃烧生成
易燃烧生成 、
、 C .
C .  分子是含有极性键的极性分子
D .
分子是含有极性键的极性分子
D .  中硫元素的化合价为
中硫元素的化合价为 价
价
最近更新




