相似相溶原理及其应用 知识点题库
根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是( )
A . 乙烯
B . 二氧化碳
C . 二氧化硫
D . 氢气
下列最适合溶解硫粉(S8)的溶剂是( )
A . 水
B . CH3OH
C . CS2
D . CH3COOH
现已知O3分子为V字形结构,O3在水中的溶解度和O2比较要大或小( )
A . O3在水中的溶解度和O2一样
B . O3在水中的溶解度比O2小
C . O3在水中的溶解度比O2要大
D . 没办法比较
下列各组混合物中,不能互溶的是( )
A . 乙醇和碘水
B . 乙醇和乙酸
C . 甲醛和水
D . 苯和水
将几种分子晶体在水和四氯化碳中的溶解情况填入下表(填“易溶”或“不易溶”):
蔗糖 | 磷酸 | 碘 | 萘 | |
(1)水 |
|
|
|
|
(2)四氯化碳 |
|
|
|
|
其原因是
下列现象不能用“相似相溶”解释的是( )
A . 二氧化硫易溶于水
B . 用CCl4 萃取碘水中的碘
C . 氯气易溶于NaOH溶液
D . 苯与水混合静置后分层
根据物质溶解性“相似相溶”的一般规律,能说明碘、溴单质在CCl4中比在水中溶解度大的是( )
A . 溴、碘单质和CCl4中都含有卤素
B . 溴、碘是单质,CCl4是化合物
C . Cl2、Br2、I2是非极性分子,CCl4也是非极性分子,而水为极性分子
D . 以上说法都不对
根据相似相溶的一般规律,若要溶解NH3应选用( )
A . 水
B . CCl4
C . 苯
D . 汽油(非极性分子)
下列对一些实验事实的解释正确的是( )
| 选项 | 实验事实 | 解释 |
| A | 水加热到较高温度都难以分解 | 水分子间存在氢键 |
| B | 白磷为正四面体分子 | 白磷分子中P-P键间的键角是109°28′ |
| C | 用苯萃取碘水中的I2 | 苯和I2均为非极性分子且苯与水不互溶 |
| D | H2O的沸点高于H2S | H-O键的键长比H-S键的键长短 |
A . A
B . B
C . C
D . D
下列对分子性质的解释中,错误的是( )

A . 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B . 乳酸(  )分子中含有一个手性碳原子
C . 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D . 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
)分子中含有一个手性碳原子
C . 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D . 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
下列物质中,难溶于CCl4的是( )
A . 碘单质
B . 水
C . 苯
D . 甲烷
下列各项比较中前者高于(或大于或强于)后者的是( )
A . CCl4和SiCl4的熔点
B . 对羟基苯甲醛(  )和邻羟基苯甲醛(
)和邻羟基苯甲醛(  )的沸点
C . I2在水中的溶解度和I2在CCl4溶液中的溶解度
D . H2SO3和H2SO4的酸性
)的沸点
C . I2在水中的溶解度和I2在CCl4溶液中的溶解度
D . H2SO3和H2SO4的酸性
分别将下列各物质等体积混合,在室温下剧烈振荡,静置后能形成均匀溶液的是( )
A . 乙酸乙酯 水
B . 苯 水
C . 乙醇 水
D . 四氯化碳 碘水
下列关于物质性质的描述正确的是( )
A . 熔点:干冰>二氧化硅
B . 共价键的极性:  C . 在水中的溶解度:
C . 在水中的溶解度:  D . 酸性:
D . 酸性: 
 C . 在水中的溶解度:
C . 在水中的溶解度:  D . 酸性:
D . 酸性: 
乙酰水杨酸(  )又名阿司匹林,是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[
)又名阿司匹林,是世界上应用最广泛的解热、镇痛和抗炎药。乙酰水杨酸受热易分解,分解温度为128℃~135℃。某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[  ]为主要原料合成阿司匹林,反应原理如下:
]为主要原料合成阿司匹林,反应原理如下:
 ]为主要原料合成阿司匹林,反应原理如下:
]为主要原料合成阿司匹林,反应原理如下:  +(CH3CO)2O
+(CH3CO)2O 
 +CH3COOH
+CH3COOH
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
请根据以上信息回答下列问题:
-
(1) 制备阿司匹林时要使用干燥的仪器,其原因是。
-
(2) 合成阿司匹林时,最合适的加热方法是。
-
(3) 提纯粗产品流程如下,加热回流装置如图。

粗产品




 乙酰水杨酸
乙酰水杨酸①实验过程中发现忘记加沸石,正确的处理方法是
②冷凝水的进水口是(填“a”或“b”)。
③提纯实验中乙酸乙酯的作用为。
④请设计实验判断粗产品中是否有未反应完全的水杨酸。
-
(4) 在实验中原料用量:3.0g水杨酸、10.0mL醋酸酐(
 ),最终称得产品质量为3.2g,则所得乙酰水杨酸的产率为(用百分数表示,保留小数点后一位)。
),最终称得产品质量为3.2g,则所得乙酰水杨酸的产率为(用百分数表示,保留小数点后一位)。
下列说法中错误的是( )
A . 邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
B . 碘易溶于四氦化碳,  在水中的溶解度很小都可用“相似相溶”原理解释
C . 向含0.1mol
在水中的溶解度很小都可用“相似相溶”原理解释
C . 向含0.1mol  的水溶液中加入足量
的水溶液中加入足量 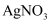 溶液只生成0.1mol AgCl
D . 液态氟化氢中氟化氢分子之间形成氢键,可写为
溶液只生成0.1mol AgCl
D . 液态氟化氢中氟化氢分子之间形成氢键,可写为  ,则
,则  分子间也是因氢键而聚合形成
分子间也是因氢键而聚合形成 
 在水中的溶解度很小都可用“相似相溶”原理解释
C . 向含0.1mol
在水中的溶解度很小都可用“相似相溶”原理解释
C . 向含0.1mol  的水溶液中加入足量
的水溶液中加入足量 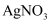 溶液只生成0.1mol AgCl
D . 液态氟化氢中氟化氢分子之间形成氢键,可写为
溶液只生成0.1mol AgCl
D . 液态氟化氢中氟化氢分子之间形成氢键,可写为  ,则
,则  分子间也是因氢键而聚合形成
分子间也是因氢键而聚合形成 
 (三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐
(三草酸合铁酸钾)为亮绿色晶体,易溶于水,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室用莫尔盐  制备
制备  的流程如图所示。
的流程如图所示。 
回答下列问题:
-
(1)
 中铁离子的配位数为,其配体
中铁离子的配位数为,其配体  中C原子的杂化方式为。
中C原子的杂化方式为。
-
(2) 步骤②发生反应的化学方程式为。
-
(3) 步骤③将
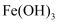 加入到
加入到  溶液中,水浴加热,控制溶液pH为
溶液中,水浴加热,控制溶液pH为  ,随反应进行需加入适量(已知:常温下
,随反应进行需加入适量(已知:常温下  溶液的pH约为3.5)。
溶液的pH约为3.5)。
-
(4) 得到的三草酸合铁酸钾晶体依次用少量冰水、95%乙醇洗涤的目的是。
-
(5) 某研究小组将
 在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和
在一定条件下加热分解,利用下图装置(可重复使用)验证所得气体产物中含有CO和  。
。 
①按气流从左到右的方向,依次连接的合理顺序为(填装置序号)。
②确认气体产物中含CO的现象为。
氨硼烷(NH3BH3)的结构和乙烷相似,下列关于NH3BH3的叙述正确的是( )
A . 氨硼烷不溶于水
B . 氨硼烷不易被氧化
C . 分子中存在N—B共价键
D . 氨硼烷为原子晶体,具有很高的熔点
我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇,为碳中和目标的实现起到了科技支持。回答下列问题:
-
(1)
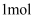
 分子中含有NA的
分子中含有NA的 键,其中碳原子的杂化类型是,
键,其中碳原子的杂化类型是, 分子的价层电子对互斥模型(VSEPR模型)是。
分子的价层电子对互斥模型(VSEPR模型)是。
-
(2) 太阳能电池板主要材料为单晶硅或多晶硅,
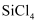 是生产高纯硅的前驱体,
是生产高纯硅的前驱体,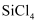 可发生水解反应,机理如下:
可发生水解反应,机理如下:

①基态
 原子的电子排布式为;
原子的电子排布式为;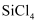 分子中
分子中 采取的杂化类型为。
采取的杂化类型为。②在
 中的四种元素,电负性最大的元素是(填元素符号,下同),其原子的原子半径最大的是。
中的四种元素,电负性最大的元素是(填元素符号,下同),其原子的原子半径最大的是。③含s、p、d轨道的杂化类型有:①
 、②
、② 、③
、③ , 中间体SiCl4(H2O)中
, 中间体SiCl4(H2O)中 采取的杂化类型为(填标号)。
采取的杂化类型为(填标号)。 -
(3) 甲醇的结构简式为
 , 与水任意比互溶,说明甲醇在水中溶解度很大的主要原因是。
, 与水任意比互溶,说明甲醇在水中溶解度很大的主要原因是。
-
(4)
 、
、 和
和 分子的空间结构和相应的键角如图所示。
分子的空间结构和相应的键角如图所示。

①
 的沸点比
的沸点比 要高,原因是。
要高,原因是。②
 分子中的键角小于
分子中的键角小于 的,分析原因是。
的,分析原因是。 -
(5) 我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为
 固溶体。
固溶体。
①元素硒(
 )的原子序数是34,
)的原子序数是34, 在元素周期表的位置是;元素
在元素周期表的位置是;元素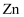 在元素周期表的位置是第四周期第ⅡB族,属于区。
在元素周期表的位置是第四周期第ⅡB族,属于区。②基态
 原子的价电子排布式是。
原子的价电子排布式是。
三氟乙酸乙酯 是制备某种抗新冠病毒药物的原料,下列说法错误的是( )
是制备某种抗新冠病毒药物的原料,下列说法错误的是( )
 是制备某种抗新冠病毒药物的原料,下列说法错误的是( )
是制备某种抗新冠病毒药物的原料,下列说法错误的是( )
A . 该分子是极性分子,所以在水中的溶解度很大
B . 该分子中的碳原子有两种杂化方式
C . 合成该分子所需的原料三氟乙酸的酸性大于乙酸
D . 1个该分子中含有13个σ键和1个π键
最近更新



