分子间作用力与物质的性质 知识点题库
将下列晶体熔化:NaOH、SiO2、CaO、CCl4 , 需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是( )
A . ②①②③
B . ①②②③
C . ②③②①
D . ①①②③
下列变化需克服相同类型作用力的是( )
A . 碘和干冰的升华
B . 硅和C60的熔化
C . 氯化氢和氯化钠的溶解
D . 液溴和液汞的汽化
下列说法中,不正确的是( )
A . 干冰升华,克服的是CO2的分子间作用力
B . 碳原子间连接方式的多样性,是含碳化合物种类繁多的原因之一
C . 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D . NH4Cl属于离子化合物,该物质中存在离子键和共价键
下列说法正确的是( )
A . 金属与非金属元素形成的化合物一定是离子化合物
B . 干冰气化过程中只需克服分子间作用力
C . HF的热稳定性很好,是因为HF分子间存在氢键
D . 常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构
下列物质发生变化时,所克服的粒子间相互作用属于分子间作用力的是( )
A . 酒精受热变为气体
B . 氯化铵受热变为气体
C . 二氧化硅受热熔化
D . 食盐溶解在水中
一种芳纶纤维的拉伸强度比钢丝还高,广泛用作防护材料。其结构片段如下图
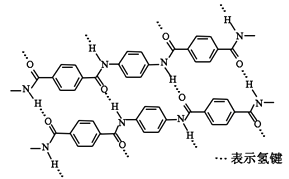
下列关于该高分子的说法正确的是( )
A . 完全水解产物的单个分子中,苯环上的氢原子具有不同的化学环境
B . 完全水解产物的单个分子中,含有官能团一COOH或一NH2
C . 氢键对该高分子的性能没有影响
D . 结构简式为: 
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价。下列说法正确的是()
A . XH4的沸点比YH3高
B . X与W形成的化合物和Z与W形成的化合物的化学键类型相同
C . 元素W的最高价氧化物对应水化物的酸性比Y的弱
D . X与Y形成的化合物的熔点可能比金刚石高
下列说法正确的是( )
A . 碘晶体受热变成蒸汽,吸收的热量用于克服碘原子间的作用力
B . 金刚石、富勒烯、干冰都是由共价键形成的原子晶体
C . HCl溶于水后,化学键被破坏,形成水合离子
D . CH4、PCl3分子中各原子均达到8电子稳定结构
铁氮化合物(  )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某  的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
 )在磁记录材料领域有着广泛的应用前景。某
)在磁记录材料领域有着广泛的应用前景。某  的制备需铁、氮气、丙酮和乙醇参与。
的制备需铁、氮气、丙酮和乙醇参与。
-
(1)
 基态核外电子排布式为。
基态核外电子排布式为。
-
(2) 丙酮(
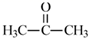 )分子中碳原子轨道的杂化类型是,1mol丙酮分子中含有σ键的数目为。
)分子中碳原子轨道的杂化类型是,1mol丙酮分子中含有σ键的数目为。
-
(3) C,H,O三种元素的电负性由小到大的顺序为。
-
(4) 乙醇的沸点高于丙酮,这是因为。
-
(1) 比较相同条件下微粒得到电子的能力Fe3+Cu2+(填“>” 、“<”或“=”)
-
(2) 已知Mg3N2遇水会剧烈反应生成白色沉淀和有刺激性气味的气体,写出Mg3N2与足量稀盐酸反应的化学方程式。
-
(3) 相同条件下冰的密度比水小,主要原因是 。
下列说法错误的是( )
A . 华为“麒麟990”手机芯片的主要成分是晶体硅
B . 新冠病毒DNA分子内存在氢键,氢键具有方向性和饱和性
C . 血红蛋白的载氧能力是通过分子中的Fe2+与O2形成离子键来实现的
D . 紫外线能使蛋白质分子中的C-C、C-N等化学键断裂,从而损伤皮肤
下列对分子结构及其性质的解释中,错误的是( )
A . 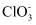 与
与  中心原子的价层电子对数相同
B . 液态氟化氢的化学式有时写成(HF)n的形式与氢键有关
C . 碘易溶于四氯化碳、甲烷难溶于水都可用相似相溶原理解释
D . 酸性:H3PO4>HClO,是因为H3PO4分子中氢原子数比HClO的多
中心原子的价层电子对数相同
B . 液态氟化氢的化学式有时写成(HF)n的形式与氢键有关
C . 碘易溶于四氯化碳、甲烷难溶于水都可用相似相溶原理解释
D . 酸性:H3PO4>HClO,是因为H3PO4分子中氢原子数比HClO的多
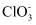 与
与  中心原子的价层电子对数相同
B . 液态氟化氢的化学式有时写成(HF)n的形式与氢键有关
C . 碘易溶于四氯化碳、甲烷难溶于水都可用相似相溶原理解释
D . 酸性:H3PO4>HClO,是因为H3PO4分子中氢原子数比HClO的多
中心原子的价层电子对数相同
B . 液态氟化氢的化学式有时写成(HF)n的形式与氢键有关
C . 碘易溶于四氯化碳、甲烷难溶于水都可用相似相溶原理解释
D . 酸性:H3PO4>HClO,是因为H3PO4分子中氢原子数比HClO的多
铜是人类最早发现并广泛使用的一种金属。回答下列问题:
-
(1) 黄铜矿(CuFeS2)是其中铜的主要存在形式。CuFeS2中存在的化学键类型是。试比较组成黄铁矿的三种组成元素的电负性的相对强弱。
-
(2) 在较低温度下CuFeS2与浓硫酸作用时,有少量臭鸡蛋气味的气体X产生。
①则X是(填名称),X分子的立体构型是,中心原子杂化类型为。
②X的沸点比水的沸点(填“高”、“低"),主要原因是。
-
(3) [Cu(NH3)4]2+中,提供孤对电子的是。Cu(NH3)2Cl2有两种同分异构体,其中种可溶于水,则此种化合物是(填“极性"或“非极性")分子,由此推知[Cu(NH3)4]2+的空间构型是。
-
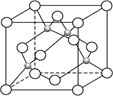
(4) 某镍白铜合金的立方品胞结构如图所示:
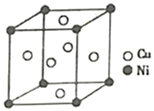
①晶胞中铜原子与镍原子的数量比为。
②若合金的密度为d g/cm3 , 品胞参数a=nm。(设NA代表阿伏加德罗常数)
下列有机物相关说法正确的是( )
A . 氨基酸和蛋白质分子中均含有酰胺键
B . 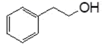 与
与 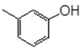 互为同系物
C . 按系统命名法,化合物
互为同系物
C . 按系统命名法,化合物  的名称是2,3,3,5,5-五甲基-4-乙基己烷
D .
的名称是2,3,3,5,5-五甲基-4-乙基己烷
D . 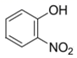 比
比  熔沸点低,是因为前者形成分子内氢键
熔沸点低,是因为前者形成分子内氢键
 的名称是2,3,3,5,5-五甲基-4-乙基己烷
D .
的名称是2,3,3,5,5-五甲基-4-乙基己烷
D .  比
比  熔沸点低,是因为前者形成分子内氢键
熔沸点低,是因为前者形成分子内氢键
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
-
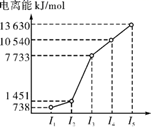
(1) 第三周期的某主族元素,其第一至第五电离能数据如图所示,则该元素对应的原子有种不同空间运动状态的电子。
-
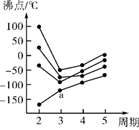
(2) 如图所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中 a 点代表的是。判断依据是。
-
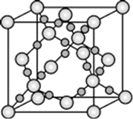
(3) CO2 在高温高压下所形成的晶体其晶胞如图所示。则该晶体的类型属于晶体。
-
(4) 第一电离能介于 Al、P 之间的第三周期元素有种。 GaCl3 中中心原子的杂化方式为,写出与 GaCl3 结构相同的一种离子。
-
(5) 下图是碳化硅的晶胞结构 。若碳化硅晶胞边长为 apm,阿伏加德罗常数为 NA ,则碳化硅晶体的密度为g/cm3.(列出计算式即可)
德国科学家发现新配方:他使用了远古地球上存在的  、
、  、
、  、
、  、
、  和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法错误的是( )
和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法错误的是( )
 、
、  、
、  、
、  、
、  和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法错误的是( )
和HCN,再使用硫醇和铁盐等物质合成RNA的四种基本碱基。下列说法错误的是( )
A . 基态  价电子排布为
价电子排布为  B .
B .  、
、  、
、  分子间均存在氢键
C .
分子间均存在氢键
C .  、
、  、HCN中均存在
、HCN中均存在  键和
键和  键
D . 沸点:
键
D . 沸点:  (乙硫醇)>
(乙硫醇)> 
 价电子排布为
价电子排布为  B .
B .  、
、  、
、  分子间均存在氢键
C .
分子间均存在氢键
C .  、
、  、HCN中均存在
、HCN中均存在  键和
键和  键
D . 沸点:
键
D . 沸点:  (乙硫醇)>
(乙硫醇)> 
近年来,科学家研究的以复合过渡金属镍的氢氧化物为催化剂、三乙醇胺为电子给体以及  为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原  。
。
 为光敏剂的催化体系,在可见光驱动下可高效催化还原
为光敏剂的催化体系,在可见光驱动下可高效催化还原  。
。
-
(1) 下列有关
 原子的叙述正确的是___________ (填标号)。
A . 第一电离能比钙的大 B . 基态
原子的叙述正确的是___________ (填标号)。
A . 第一电离能比钙的大 B . 基态 原子的核外价电子排布式为
原子的核外价电子排布式为  C . 基态
C . 基态 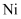 原子形成基态
原子形成基态 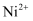 时,先失去
时,先失去  轨道上的电子
轨道上的电子
-
(2) 三乙醇胺的制备:3

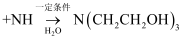 。
。 ①三乙醇胺所含的元素中,电负性由小到大的顺序为。
②
 的空间结构为。
的空间结构为。③键角:
 (填“
(填“  ”、“
”、“ 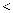 ”或“
”或“  ”)
”)  。
。 -
(3)
 能转化为高价值化学品,如
能转化为高价值化学品,如  、
、  、
、 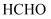 。上述3种物质中,沸点最高的是
。上述3种物质中,沸点最高的是  ,原因是。
,原因是。
-
(4)
 的结构如图所示。
的结构如图所示。  原子的杂化类型为,
原子的杂化类型为, 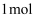 配体
配体 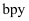 分子中含有
分子中含有  键的数目为
键的数目为  。
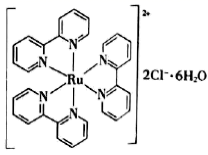
。 
-
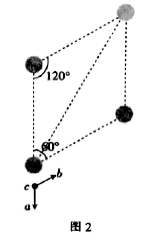
(5)
 的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置。已知晶胞的底边长为
的晶胞结构如图1(氧、氢原子均位于晶胞内部)所示,图2是晶胞正上方的俯视投影图,请在图2中用空心球(○)表示氧原子的位置。已知晶胞的底边长为 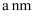 ,高为
,高为 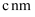 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为  ,则该晶胞的密度为
,则该晶胞的密度为 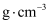 (列出表达式)。
(列出表达式)。 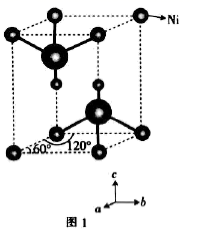
-
(1) 铜与类卤素(SCN)2反应生成Cu(SCN)2 , 1mol(SCN)2中含有π键的数目为; 类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H-S-C
 N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是 。
N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是 。
-
(2) H2O2与H2O可以以任意比例互溶,除因为它们都是极性分子外,还因为。
-
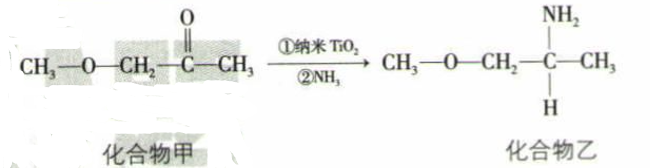
(3) 纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图所示,化合物甲中碳原子的杂化方式为,组成化合物乙的所有元素的第一电离能由大到小的顺序为。化合物乙的沸点明显高于化合物甲,主要原因是。
化合物Z是一种具有广谱抗菌活性的药物,其合成反应如图。下列说法错误的是( )
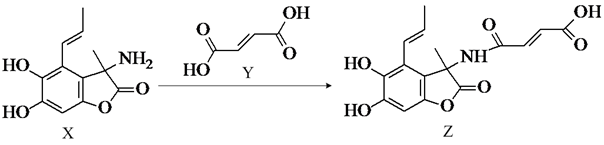
A . X分子间只能形成下列氢键:O-H…O、N-H…N
B . 1molZ最多能与6molNaOH反应
C . Z分子中含2个手性碳原子
D . X、Y、Z三种分子均存在顺反异构体
下列两组命题中,M组命题能用N组命题加以解释的是( )
选项 | M组 | N组 |
A | 酸性强弱:三氟乙酸>三氯乙酸 | F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大 |
B |
| 因为 |
C |
|
|
D | HI的沸点比HCl的高 | H-I键的键能大于H-Cl键的键能 |
A . A
B . B
C . C
D . D
最近更新
 的稳定性大于
的稳定性大于



