分子间作用力对物质的状态等方面的影响 知识点题库
下列说法正确的是( )
A . 当分子间距离增大时,分子间的引力增大、斥力减小
B . 温度是系统中分子总动能大小的标志
C . 布朗运动指的是悬浮小颗粒的无规则运动
D . 当系统与外界没有热交换时,温度一定保持不变
下列说法不正确的是( )
A . 从HCl、HBr到HI的熔点沸点升高与范德华力大小有关
B . H2O的熔点沸点大于H2S,是由于H2O分子之间存在氢键这种化学键
C . 乙醇与水互溶可以用相似相溶原理解释
D . 甲烷分子不可能与水分子形成氢键
下列物质沸点最高的是( )
A . 丙烷
B . 丁烷
C . 正戊烷
D . 新戊烷
部分有机物的熔沸点见下表:
烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |
|
|
|
沸点/℃ | ﹣164 | ﹣88.6 | ﹣0.5 | 熔点/℃ | 45 | 96 | 114 |
根据物质结构理论,由这些数据你能得出的相关结论是(至少写2条):
沸点比较:邻羟基苯甲醛对羟基苯甲醛(填“>”、“<”或“=”)
下列物质的沸点由高到低的排列正确的是( )
①丙烷②乙二醇③乙醇④丁烷⑤乙烷⑥2﹣甲基丙烷.
A . ②③⑥④①⑤
B . ②③④⑥①⑤
C . ④⑥①②③⑤
D . ④①③⑥②⑤
下列化合物的沸点比较,前者低于后者的是( )
A . 乙醇与氯乙烷
B . 邻羟基苯甲酸与对羟基苯甲酸
C . 对羟基苯甲醛与邻羟基苯甲醛
D . H2O与H2Te
氮化硼是一种新合成的无机材料,它是一种超硬耐磨、耐高温、抗腐蚀的物质。下列各组物质熔化时所克服的粒子间的作用力与氮化硼熔化时所克服的粒子间的作用力类型相同的是( )
A . 硫酸钠和金刚石
B . 冰和干冰
C . 晶体硅和水晶
D . 苯和四氯化碳
下列物质的变化,仅破坏范德华力的是( )
A . 碘单质的升华
B . NaCl溶于水
C . 将水加热变为水蒸气
D . NH4Cl受热
下列各组物质气化或熔化时,所克服的微粒间作用力完全相同的是( )
A . 碘的升华和干冰气化
B . 二氧化硅和干冰熔化
C . 苯和硝酸钾熔化
D . 食盐和冰熔化
-
(1) 用一个离子方程式说明
 结合
结合  能力强于
能力强于  。
。
-
(2) 写出甲基的电子式。
-
(3) 常温常压下,氯气为气体,溴单质为液体,其原因是。
-
(1) 已知金刚石中C-C键能小于C60中C-C键能,有同学据此认为C60的熔点高于金刚石,认为此说法是否正确(填“正确”或“不正确”),并闸述理由。
-
(2) 格式试剂RMgX(R表示烃基、X表示卤素)遇水剧烈反应,生成可燃性烃RH和 。
-
(3) 64g自燃性气体SiH4在25℃、101Kpa下充分完全燃烧生成液态水和固态氧化物时放出akJ热量,写出该自燃性气体燃烧热的热化学方程式。
下列说法正确的是( )
A . 范德华力非常微弱,破坏范德华力不需要消耗能量
B . H2O的沸点低于NH3
C . H2O是一种稳定的化合物,这是氢键所致
D . 范德华力:HI>HBr>HCl
水可以发生如下变化:
冰  液态水(4℃)
液态水(4℃)  水蒸气(100℃)
水蒸气(100℃)  氢气+氧气
氢气+氧气
下列说法正确的是( )
A . 过程①中物质体积膨胀
B . 过程②中分子间距缩小
C . 过程③中涉及化学键的断裂和形成
D . 过程②与过程④互为可逆反应
下列关于聚集状态的叙述中,错误的是( )
A . 物质只有气.液.固三种聚集状态
B . 气态是高度无序的体系存在状态
C . 固态中的原子或者分子结合的较紧凑,相对运动较弱
D . 液态物质的微粒间距离和作用力的强弱介于固.气两态之间,表现出明显的流动性
如图是石墨、足球烯(C60)、金刚石三种晶体的结构示意图,下列说法正确的是( )
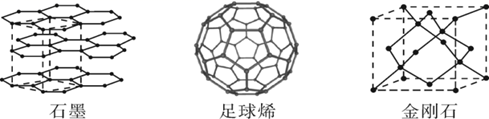
A . 这三种物质是碳的同分异构体,燃烧产物相同
B . 这三种物质熔化时,克服的粒子间作用力完全相同
C . 等物质的量的石墨、金刚石所含的C—C键数目之比为3:4
D . 已知C(s,石墨)=C(s,金刚石)ΔH=+1.9kJ·mol-1 , 则金刚石比石墨稳定
下列叙述错误的是( )
A . H2O很稳定,与水分子间存在氢键有关
B . F2、Cl2、Br2、I2的熔点依次升高,与它们的分子间作用力依次增大有关
C . 液态HCl不导电而熔融NaCl能导电,与前者为共价化合物而后者为离子化合物有关
D . 干冰(CO2)易升华而石英(SiO2)不易熔,与前者克服的是分子间作用力而后者克服的是共价键有关
下列说法正确的是( )
A . 冰融化时,分子中有H-O键发生断裂
B . 卤化物CX4(X代表卤族元素)中,从F到I,分子间作用力逐渐增大,它们的熔沸点也逐渐升高
C . 由于H-O键比H-S键牢固,所以水的熔沸点比H2S高
D . 在由分子所构成的物质中,分子间作用力越大,该物质越稳定
对下列实验事实的理论解释错误的( )
选项 | 实验事实 | 理论解释 |
A | 环状S8分子结构如图 | S原子采取的杂化方式为sp3 |
B | SO2易溶于水而难溶于CCl4 | SO2和水都是极性分子而CCl4为非极性分子 |
C | HF分子热稳定性比HCl强 | HF分子间作用力比HCl强 |
D | Fe2+比Fe3+的稳定性小 | Fe2+和Fe3+的价电子排布式分别为3d6、3d5 , Fe3+的3d能级为半充满的稳定结构 |
A . A
B . B
C . C
D . D
下列说法正确的是( )
A . HF、HCl、HBr、HI的熔、沸点依次升高
B . CH4、CCl4都是含有极性键的非极性分子
C . CS2、H2SC,H2都是直线形分子
D . 在水中的溶解性:戊醇>乙二醇>乙醇
最近更新







