化合价与化学式 知识点题库
在5ml0.05mol/L的某金属氯化物的溶液中,滴加0.1mol/LAgNO3溶液,生成沉淀的质量与加入AgNO3溶液的体积关系如图所示,则该氯化物中金属元素的化合价为( )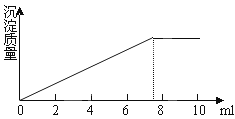
A . +1
B . +2
C . +3
D . +4
请用化学用语回答下列问题:
-
(1) 漂白粉的有效成分为.
-
(2) 标出氢化钠中氢元素的化合价:.
-
(3) NaHSO4在水中溶解时的电离方程式为.
-
(4) 工业合成氨的化学方程式为.
-
(5) 加热饱和FeCl3溶液形成Fe(OH)3胶体的离子方程式为.
-
(6) 向明矾水溶液中加入过量的氢氧化钡溶液,发生反应的离子方程式为.
某元素R的最高价氧化物的水化物分子式是HnRO2n﹣2 , 则在气态氢化物中R元素的化合价是( )
A . 3n﹣10
B . 12﹣3n
C . 3n﹣4
D . 3n﹣12
在等物质的量的短周期金属元素单质A和B中,分别加入足量的酸,在A中加入盐酸,B中加入稀硫酸,反应完全后,生成氢气的体积分别为V(A)和V(B),且V(A)≠V(B),若要确定反应生成物中A和B的化合价,至少还需知道的数据是( )
A . V(A):V(B)的值
B . V(A)(或V(B))的值
C . A(或B)的物质的量
D . 盐酸和硫酸的物质的量浓度
一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
-
(1) 硼酸(H3BO3) 为一元酸,硼酸中B 的化合价为。
-
(2) 已知:Ka(H3BO3) =5.8×10-10 , Ka(H2CO3) =4.4×10-7 , Ka(HCO3-) =4.7×10-11 , 向饱和硼酸溶液中滴加0.1 mol•L-1Na2CO3溶液,(填“能”或“不能”)观察到气泡逸出。写出该反应的化学方程式。
-
(3) 以硼酸为原料可制备重要还原剂NaBH4 , BH4-的电子式为。NaBH4 与BF3 在50℃~70℃反应生成NaBF4 和乙硼烷(B2H6),该反应的化学方程式是。
-
(4) 硫酸溶解铁硼矿可制得含Fe3+、Fe2+、Al3+ 杂质的硼酸溶液,提纯过程中加入H2O2的目的是,为除去Fe3+、Al3+ (使其浓度均小于1×10-6 mol·L-1),需至少调节pH=(已知: Ksp[Al(OH)3]= 1×10-33 , Ksp[Fe(OH)3]=4×10-38)
-
(5) H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①a接电源的 (填“正极”、“ 负极”)
②写出阳极的电极反应式。
③原料室中阴、阳离子是如何迁移的?。
NaBH4是一种重要的储氢载体,能与水反应生成NaBO2 , 反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑.下列有关说法正确的是( )
A . NaBH4中B的化合价为-5
B . 该反应的氧化剂是NaBH4
C . 氧化产物与还原产物物质的量之比为1:1
D . 反应消耗1mol NaBH4时转移2mol电子
氮化硅(Si3N4)可用作高级耐火材料、新型陶瓷材料等。已知:Si的电负性比H的小,利用硅烷(SiH4)制备氮化硅的反应为3SiH4+4NH3=Si3N4+12H2。下列有关说法正确的是( )
A . 硅烷中Si的化合价为-4价
B . NH3在该反应中作还原剂
C . H2既是氧化产物,也是还原产物
D . 转移1.2mol电子时,生成26.88LH2
2020年初春,新型冠状病毒肆虐流行,严重威胁着人类的健康。使用含氯泡腾片[主要成分为二氧化氯(ClO2)]可有效杀死病毒。下列对于二氧化氯(ClO2)的说法错误的是 ( )
A . ClO2属于化合物
B . ClO2属于氧化物
C . ClO2属于盐类
D . 根据ClO2中氯元素的化合价为+4,推测其具有氧化性
ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆英石(ZrSiO4)含有铁、铝、铜等金属元素的氧化物杂质,工业以锆英石为原料制备ZrO2的工艺流程如下:
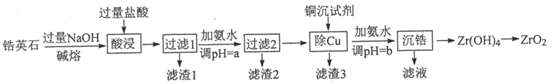
已知:
①锆英石能与烧碱高温反应生成可溶于水的Na2ZrO3 , Na2ZrO3与酸反应生成ZrO2+。
②部分离子在实验条件下开始沉淀和完全沉淀时的pH如下表:

-
(1) ZrSiO4中Zr的化合价为。滤渣2的主要成分为。
-
(2) “碱熔”过程中ZrSiO4发生反应的化学方程式。
-
(3) 本流程使用NaCN除铜,若盐酸溶解后溶液中c(Cu2+)=0.01 mol·L-1 , 当溶液中Cu2+开始沉淀时,c(CN-)=。(已知Ksp[Cu(CN)2]=4×10-10)
-
(4) 向除Cu后所得滤液中加氨水调pH=b,发生的离子方程式为。
-
(5) 过滤时需要用到的玻璃仪器。
-
(6) 由氢氧化锆制备高纯二氧化锆的方法是。
当溶液中XO  和SO
和SO  的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )
的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )
 和SO
和SO  的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )
的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )
A . +1
B . +2
C . +3
D . +4
LiFePO4是锂离子电池常用的正极材料,由FePO4制备LiFePO4的反应为2FePO4+Li2CO3+H2C2O4  2LiFePO4+H2O+3CO2↑。下列说法错误的是( )
2LiFePO4+H2O+3CO2↑。下列说法错误的是( )
 2LiFePO4+H2O+3CO2↑。下列说法错误的是( )
2LiFePO4+H2O+3CO2↑。下列说法错误的是( )
A . LiFePO4中铁的化合价为+2
B . 生成1molLiFePO4时,该反应转移2mol电子
C . 该反应中H2C2O4是还原剂,FePO4是氧化剂
D . 该反应中CO2是氧化产物,LiFePO4是还原产物
人们认识和应用物质常从两方面入手,一是从物质的类别认识该物质可能跟哪些物质发生反应;二是从物质所含元素的化合价分析该物质是否具有氧化性或还原性。如图所示是硫元素的各个价态与物质类别的对应关系:
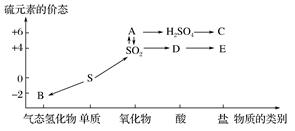
-
(1) 写出指定物质的化学式:
A,B。
-
(2) D转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式。
-
(3) 若C是铜盐,试写出由H2SO4→C的化学方程式。
-
(4) 为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2。写出该反应的化学方程式。
下图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为( )
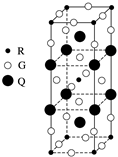
A . +1
B . +2
C . +3
D . +4
甲硫醇是一种重要的原料和化工试剂,硫化氢与甲醇合成甲硫醇的催化过程如下。下列说法中错误的是( )
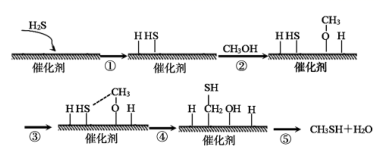
A . CH3SH中碳元素化合价为-2价
B . 过程⑤中,形成了O—H键和C—H键
C . 该催化剂可有效提高生成物的产量
D . 硫化氢与甲醇合成甲硫醇的总反应方程式为:H2S + CH3OH 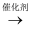 CH3SH+ H2O
CH3SH+ H2O
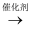 CH3SH+ H2O
CH3SH+ H2O
以物质类别为横坐标,化合价为纵坐标可以绘制某一元素的价类图。氮元素的价类图如图所示。
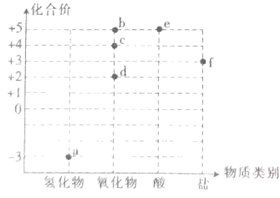
-
(1) 实验室用铜制取d的离子方程式为,生成标准状况下11.2L气体d时,消耗铜的质量为。
-
(2) c的大量排放会造成的环境问题是。工业上可用a与c在催化剂、加热条件下共同反应生成无污染的物质,写出该反应的化学方程式:,该反应中氧化剂与还原剂的物质的量之比为。
-
(3) a经过一步反应可以生成d,写出反应的化学方程式:。
我国广东、广西等省的钨锡矿床中含有黝锡矿(主要成分为  ,还含有
,还含有 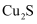 、
、 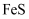 等)。一种以黝锡矿为原料提取锡的工艺流程如图所示:
等)。一种以黝锡矿为原料提取锡的工艺流程如图所示:
 ,还含有
,还含有 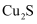 、
、 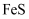 等)。一种以黝锡矿为原料提取锡的工艺流程如图所示:
等)。一种以黝锡矿为原料提取锡的工艺流程如图所示: 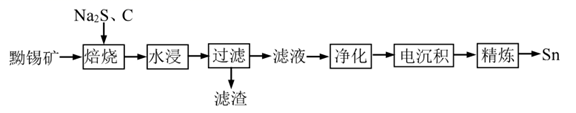
已知:“滤液”中含有的主要离子为 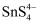 、
、 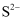 、
、  等。
等。
回答下列问题:
-
(1) “焙烧”过程中主要发生的反应为
 。
。 ①
 中
中 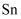 元素的化合价为。
元素的化合价为。②在反应物中加入
 粉的最主要目的是(填标号)。
粉的最主要目的是(填标号)。A.提供能量 B.防止
 被氧化 C.防止结块
被氧化 C.防止结块③加入的
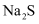 的量应为黝锡矿量的2.1倍,结合图示说明其原因。
的量应为黝锡矿量的2.1倍,结合图示说明其原因。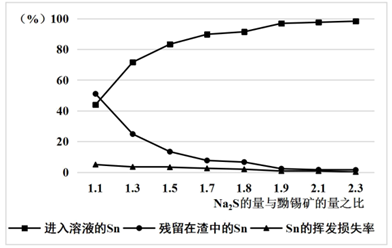
-
(2) “滤渣”中可回收的金属是(填元素符号)。
-
(3) 若黝锡矿中含有
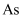 元素,则“净化”时需加入
元素,则“净化”时需加入 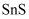 ,将
,将  转化为单质
转化为单质 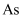 除去,发生反应的离子方程式为
除去,发生反应的离子方程式为  ,该过程可看作经历以下两步反应:
,该过程可看作经历以下两步反应: 第一步:

第二步:
-
(4) “电沉积”时,采用惰性电极作阳极,纯锡作阴极,
 溶液和“净化”后溶液(主要含
溶液和“净化”后溶液(主要含 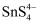 、
、  等)分别为两极区的电解液,选用阳离子交换膜。
等)分别为两极区的电解液,选用阳离子交换膜。 ①“净化”后溶液应作(填“阳极区”或“阴极区”)电解液。
②“电沉积”过程中,阳极区溶液的
 (填“增大”或“减小”或“不变”)。
(填“增大”或“减小”或“不变”)。③“电沉积”结束后,阴极区溶液的主要溶质为(填化学式)。
关于反应K2H3IO6+9HI=2KI+4I2+6H2O,下列说法正确的是( )
A . K2H3IO6中I元素的化合价为+7价
B . HI在反应中只表现还原性
C . 常温下,生成25.4g I2时,转移0.2mol电子
D . 氧化产物与还原产物的物质的量之比为1:7
如图是第三周期主族元素(11~17号)某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A . 若x轴为原子序数,y轴表示的可能是第一电离能
B . 若x轴为原子序数,y轴表示的可能是原子半径
C . 若x轴为最高正化合价,y轴表示的可能是电负性
D . 若x轴为族序数,y轴表示的可能是0.1 mol·L-1最高价氧化物对应水化物溶液的pH
火箭常用联氨( )作燃料,四氧化二氮(
)作燃料,四氧化二氮( )作助燃剂,生成物不会对大气造成污染。下列叙述正确的是( )
)作助燃剂,生成物不会对大气造成污染。下列叙述正确的是( )
 )作燃料,四氧化二氮(
)作燃料,四氧化二氮( )作助燃剂,生成物不会对大气造成污染。下列叙述正确的是( )
)作助燃剂,生成物不会对大气造成污染。下列叙述正确的是( )
A .  中的氮元素为-3价
B .
中的氮元素为-3价
B .  与四氧化二氮反应后的产物是
与四氧化二氮反应后的产物是 与
与 C .
C .  与
与 相比,后者的沸点更高
D .
相比,后者的沸点更高
D .  的结构式为:
的结构式为: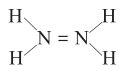
 中的氮元素为-3价
B .
中的氮元素为-3价
B .  与四氧化二氮反应后的产物是
与四氧化二氮反应后的产物是 与
与 C .
C .  与
与 相比,后者的沸点更高
D .
相比,后者的沸点更高
D .  的结构式为:
的结构式为:
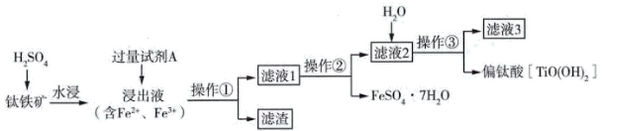
在实验室中模拟工业上以钛铁矿(主要成分为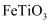 , 含杂质
, 含杂质 )为原料制取偏钛酸的流程如图。
)为原料制取偏钛酸的流程如图。
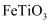 , 含杂质
, 含杂质 )为原料制取偏钛酸的流程如图。
)为原料制取偏钛酸的流程如图。
已知:向钛铁矿中加入硫酸得到硫酸氧钛(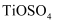 ),硫酸氧钛在加热的条件下水解得到偏钛酸,偏钛酸为难溶于水的白色沉淀。
),硫酸氧钛在加热的条件下水解得到偏钛酸,偏钛酸为难溶于水的白色沉淀。
下列叙述错误的是( )
A . 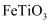 中,Ti的化合价为+4价
B . 过量试剂A为铁粉,仅起还原浸出液中
中,Ti的化合价为+4价
B . 过量试剂A为铁粉,仅起还原浸出液中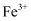 的作用
C . 操作②主要是蒸发浓缩、冷却结晶、过滤
D . 硫酸氧钛水解的离子方程式为:
的作用
C . 操作②主要是蒸发浓缩、冷却结晶、过滤
D . 硫酸氧钛水解的离子方程式为:
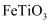 中,Ti的化合价为+4价
B . 过量试剂A为铁粉,仅起还原浸出液中
中,Ti的化合价为+4价
B . 过量试剂A为铁粉,仅起还原浸出液中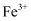 的作用
C . 操作②主要是蒸发浓缩、冷却结晶、过滤
D . 硫酸氧钛水解的离子方程式为:
的作用
C . 操作②主要是蒸发浓缩、冷却结晶、过滤
D . 硫酸氧钛水解的离子方程式为:
最近更新



