化合价与化学式 知识点题库
写出下列结晶水合物的化学式:
绿矾: ;明矾 ;蓝矾 ;石碱
氢元素形成的化合物种类众多,在下列化合物中,氢元素显示正价的是( )
A . BH3
B . SiH4
C . C2H2
D . NaH
元素R的最高价含氧酸的化学式为HnRO2n﹣2 , 则在气态氢化物中R元素的化合价为( )
A . 12﹣3n
B . 3n﹣12
C . 3n﹣10
D . 6﹣3n
绿柱石又称绿宝石,其组成可表示为A3B2(SiO4)3 , 式中A、B均为金属元素,则A、B对应的化合价依次为( )
A . +2,+3
B . +3,+2
C . +2,+2
D . +3,+3
下列含氮物质中,氮元素化合价最高的是( )
A . N2
B . HNO3
C . N2O4
D . NaNO2
化合物UF6在原子能工业有重要作用,其中元素U的化合价是( )
A . -6
B . +2
C . +3
D . +6
对下列物质中锰元素化合价的判断,正确的是( )
A . KMnO4中为+3
B . MnSO4中为 -2
C . K2MnO4中为+6
D . MnO2中为+2
下列说法正确的是( )
A . 乙酸的分子式:C2H4O
B . 甲烷的分子式:CH4
C . 乙酸的结构简式:CH3CH2OH
D . 乙烷的结构简式:C2H6
若把黄铜矿CuFeS2看作为硫化铜和硫化亚铁的缔合物,可用来制取铜和铁及硫的化合物。如:8CuFeS2+21O2  8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
-
(1) 在黄铜矿中硫的化合价为,该反应中还原产物(通过得电子而产生的物质)有种。
-
(2) 若反应中消耗氧气6.3mol,则反应转移的电子数为,其中某元素部分被氧化,则其被氧化和未被氧化的物质的量之比为。
-
(3) 反应产生污染气体,需要吸收处理,下列不可用来吸收该污染气体的是_________(选填编号)A . KMnO4溶液 B . NaOH溶液 C . H2S气体 D . NaHSO3溶液
-
(4) 某吸收方法产生的物质可能有:①Na2SO4②NaHSO4③Na2SO3④NaHSO3等。
等浓度的上述四种物质的溶液pH值由大到小的是(用编号填写),选用这些物质中的部分,实现离子反应2H++SO32-→H2O+SO2↑,写出对应的化学方程式。某NaHSO3的浓度为c1 , pH为x1 , NaHSO4溶液的浓度为c2 , pH为x2 , 若x1<x2 , 则c1c2(填“>”或“<“或“=”)。
某元素X的气态氢化物化学式为XH3 , 其最高价氧化物的水化物的化学式可能为( )
A . H2XO3
B . HXO3
C . HXO
D . H2XO4
在一定条件下,RO3n-和氟气可发生反应:RO3n- + F2+2OH-=RO4-+2F-+H2O,从而可知在RO3n-中,元素R的化合价是( )
A . +4
B . +7
C . +6
D . +5
M2O7x-与S2-在酸性溶液中发生如下反应:M2O7x-+3S2-+14H+=2M3++3S↓+7H2O,则M2O7x-中M的化合价是( )
A . +2
B . +4
C . +6
D . +3
硝酸的化学式为HNO3 , 其中氮元素的化合价为( )
A . -3
B . +2
C . +3
D . +5
硫酸铁和硫酸亚铁固体的混合物,若其中硫元素的质量分数为a%,则其中铁元素的质量分数为( )
A . (100-3a)%
B .  C .
C .  D .
D . 
 C .
C .  D .
D . 
高岭土又叫瓷土,主要由高岭石的微小晶体组成,因盛产于我国江西景德镇的高岭而得名,是制造瓷器的优良原料,其组成可表示为Al2Si2Ox(OH)y , 其中的x、y的数值分别是( )
A . 7,2
B . 5,4
C . 6,3
D . 3,6
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要含有Cu2+、Fe2+、Fe3+、H+、Cl-)制备,其制备过程如下:

Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
回答下列问题:
-
(1) NaClO3中氯元素的化合价为。
-
(2) 完成反应A的离子方程式:
 +Fe2++_=Cl-+Fe3++_,。
+Fe2++_=Cl-+Fe3++_,。
-
(3) 滤渣的成分是,调节pH的范围是,选用的试剂较好的是(填以下字母编号)。
A.硫酸 B.氨水 C.氧化铜 D.氢氧化钠
-
(4) 反应B有气泡产生,则反应B的离子方程式为。
-
(5) 滤液中回收的副产物主要是NaCl,常用于氯碱工业,电解饱和食盐水的原理示意图如下所示,溶液A的溶质是,电解时用盐酸控制阳极区pH在2~3,用平衡移动原理解释盐酸的作用。

新型洗涤剂过氧碳酸钠(  )固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(
)固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(  )的性质,下列推测不合理的是( )
)的性质,下列推测不合理的是( )
 )固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(
)固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(  )的性质,下列推测不合理的是( )
)的性质,下列推测不合理的是( )
A . 过氧碳酸钠也可作为水体供氧剂
B . 过碳酸钠中的氧元素有-1、-2两种价态
C . 过氧碳酸钠能使酸性高锰酸钾溶液褪色,体现了过氧碳酸钠的强氧化性
D . 过碳酸钠的水溶液既有碱性也有强氧化性
按照  的排列规律,则合适的X是( )
的排列规律,则合适的X是( )
 的排列规律,则合适的X是( )
的排列规律,则合适的X是( )
A . 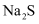 B . S
C .
B . S
C .  D .
D . 
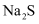 B . S
C .
B . S
C .  D .
D . 
锡、钨、锦和稀土并称为中国的四大战略资源,工业上主要以锡石(主要成分为 , 还含有
, 还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
 , 还含有
, 还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
查阅资料可知:钨酸钙( )难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
)难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
回答下列问题:
-
(1) 氧化焙烧时加快反应速率的方法有(任填一种),气体甲的主要成分是(填化学式)。
-
(2) 在固体1中加入
 溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(填化学式);固体2中Pb元素的化合价为。
溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(填化学式);固体2中Pb元素的化合价为。
-
(3) 固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为。
-
(4)
 具有强还原性,在酸性条件易被空气中的
具有强还原性,在酸性条件易被空气中的 氧化,其反应的离子方程式为。
氧化,其反应的离子方程式为。
-
(5) 通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到
 溶液,再加入过量的
溶液,再加入过量的 溶液转化为
溶液转化为 , 然后用已知浓度的
, 然后用已知浓度的 溶液去滴定生成的
溶液去滴定生成的 。现有粗锡样品0.613g,经上述各步反应后,共用去
。现有粗锡样品0.613g,经上述各步反应后,共用去 溶液16.0mL,则该粗锡样品中锡的质量分数为(假设杂质不参与反应)。
溶液16.0mL,则该粗锡样品中锡的质量分数为(假设杂质不参与反应)。
2019年诺贝尔化学奖授予在开发锂离子电池方面做出卓越贡献的三位化学家。锂离子电池的广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜主要含有LiCoO2、Al等,处理该废料的一种工艺如图所示:

回答下列问题:
-
(1) LiCoO2中Co的化合价是。
-
(2) “碱浸”时Al溶解的离子方程式为。
-
(3) “酸溶”时加入H2O2的目的是,调节pH后所得滤渣主要为。
-
(4) “沉钴”的离子方程式为。
-
(5) 磷酸铁锂电池是目前国内使用比较广泛的电池之一,磷酸铁锂的导电性能很差,但P-O键稳固,拥有良好的安全性。内部结构如图所示。

①溶剂能否是水,理由是。
②充电时,石墨电极上发生的反应是。
-
(6) 取CoC2O4、固体4.41 g在空气中加热至300℃,得到钴的氧化物2.41 g,则该反应的化学方程式为 。
最近更新



