化合价与化学式 知识点题库
取24mL 0.5mol/L Na2SO3溶液与20mL 0.2mol/L K2Cr2O7溶液恰好完全反应.则生成物中Cr元素的化合价为 价.
羟基硝酸铵[NH(OH)3NO3]是一种便于运输和存储的绿色火箭推进剂.则羟基硝酸铵[NH(OH)3NO3]的阳离子中N的化合价为:.
超导材料是具有零电阻和反磁性的物质,以Y2O3、BaCO3和CuO为原料经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox , 假设在研磨烧结过程中各元素的化合价无变化,则x的值为.
下列物质中,硫元素的化合价为+4的是( )
A . Na2SO3
B . SO3
C . Na2SO4
D . H2SO4
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

下列说法不正确的是( )
A . “酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:  B . 若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C . “高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:
B . 若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C . “高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为: D . TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
D . TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
温度/ 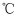 | 30 | 35 | 40 | 45 | 50 |
 转化率/% 转化率/% | 92 | 95 | 97 | 93 | 88 |
钼(Mo)是一种重要的过渡金属元素,工业上由钼精矿(主要成分是MoS2)制备单质钼和钼酸钠晶体(Na2MoO4·2H2O)的流程如下:
-
(1) Na2MoO4·2H2O中Mo元素的化合价为;钼精矿焙烧的主要反应中,氧化剂和还原剂物质的量之比为。
-
(2) 流程中由Na2MoO4溶液获得晶体的操作是、过滤、洗涤、干燥。加入Na2CO3溶浸时发生的主要反应的离子方程式为。
-
(3) 操作1中,所得Na2MoO4溶液中含SO42+杂质,其中c(MoO42+)0.80mol/L,c(SO42-)=0.04mol/L在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当 BaMoO4开始沉淀时,SO42-的去除率是。[Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8 , 溶液体积变化可忽略]
-
(4) 工业上钼精矿在酸性条件下,加入NaNO3溶液,也可以制备钼酸钠,该法的优点是。
-
(5) 高纯Mo可用于制造电池级MoS2 , Li-MoS2电池是一种性能优异的二次电池,其电池反应为:xLi+nMoS2
 Lix(MoS2)n , 该电池放电时正极反应为;充电时Li+移动方向为(填“由阳极移向阴极”或“由阴极移向阳极”)。
Lix(MoS2)n , 该电池放电时正极反应为;充电时Li+移动方向为(填“由阳极移向阴极”或“由阴极移向阳极”)。
下列关于Na与F的说法正确的是( )
A . F元素的最高正价为+7
B . Na原子与F原子都是两个电子层
C . 原子半径:Na >F
D . 用电子式表示NaF的形成过程为 
-
(1) 现有下列十种物质:① H2O、② 空气、③ Mg、④ H2SO4、⑤ CaO、⑥ CuSO4、⑦ 碘酒、⑧ Ca(OH)2、⑨ 酒精、⑩ NaHCO3 , 其中属于混合物的是(填序号,下同),属于氧化物的是,属于酸的是,属于碱的是,属于盐的是。
-
(2) 用化学用语填空:
氯原子的结构示意图;Na2O2中氧元素的化合价为;5个磷酸根离子;
-
(3) NH4+的摩尔质量为。
Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:

下列说法错误的是( )
A . “酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl- = Fe2++ TiOCl42-+2H2O
B . 若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C . “高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4  2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑
D . TiO2 ·xH2O沉淀与双氧水、氨水反应40min所得实验结果如上表所示, 40 oC前,未达到平衡状态,随着温度升高,转化率变大
 2LiFePO4+H2O+3CO2↑
2LiFePO4+H2O+3CO2↑ 温度/  | 30 | 35 | 40 | 45 | 50 |
| TiO2 ·xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
40mL物质的量浓度为0.05mol▪L-1Na2SO3溶液恰好与25mL浓度为0.02mol▪L-1的K2X2O6溶液完全反应,已知Na2SO3可被K2X2O6氧化为Na2SO4 , 则元素X在还原产物中的化合价为下列的( )
A . +1价
B . +2价
C . +3价
D . +4价
《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠去除工业废水中正五价砷(As(V))的研究成果,其反应机理模型如图所示,下列说法正确的是( )

A .  转化为
转化为  或
或  时,硫元素化合价由+7降低至+6
B . 整个反应过程中
时,硫元素化合价由+7降低至+6
B . 整个反应过程中  作催化剂,
作催化剂,  为中间产物
C . 自由基
为中间产物
C . 自由基  有强氧化性
D . 溶液的pH越小,越有利于去除废水中的正五价砷
有强氧化性
D . 溶液的pH越小,越有利于去除废水中的正五价砷
 转化为
转化为  或
或  时,硫元素化合价由+7降低至+6
B . 整个反应过程中
时,硫元素化合价由+7降低至+6
B . 整个反应过程中  作催化剂,
作催化剂,  为中间产物
C . 自由基
为中间产物
C . 自由基  有强氧化性
D . 溶液的pH越小,越有利于去除废水中的正五价砷
有强氧化性
D . 溶液的pH越小,越有利于去除废水中的正五价砷
焦亚硫酸钠(Na2S2O5)是葡萄酒中常用的抗氧化剂。一种以硫黄为原料制取Na2S2O5的生产工艺如下:
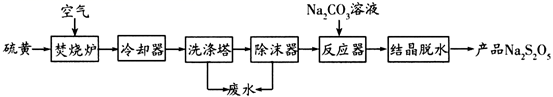
已知:结晶脱水发生的反应: 
回答下列问题:
-
(1) Na2S2O5中硫元素的化合价为。
-
(2) 焚烧炉中反应的化学方程式为。
-
(3) 反应器中发生反应的离子方程式为。
-
(4) 葡萄酒酿造过程中添加Na2S2O5会放出一种有刺激性气味的气体,该气体是一种食品添加剂。实验室中检验该气体的常用试剂是。
-
(5) 废水中的硫单质(S8)能与碱反应,化学反应:
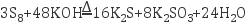 ,反应中氧化剂与还原剂的物质的量之比为。
,反应中氧化剂与还原剂的物质的量之比为。
已知  可与
可与  反应,
反应,  被氧化,产物为
被氧化,产物为  单质,
单质,  被还原,产物为
被还原,产物为  ,且
,且  与
与  的化学计量数之比为
的化学计量数之比为 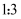 ,则
,则  值为( )
值为( )
 可与
可与  反应,
反应,  被氧化,产物为
被氧化,产物为  单质,
单质,  被还原,产物为
被还原,产物为  ,且
,且  与
与  的化学计量数之比为
的化学计量数之比为 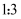 ,则
,则  值为( )
值为( )
A . 4
B . 5
C . 7
D . 6
已知:某含氯元素的粒子M与  发生氧化还原反应的离子方程式为
发生氧化还原反应的离子方程式为  (已配平)。则物质M、N中氯元素的化合价分别为( )
(已配平)。则物质M、N中氯元素的化合价分别为( )
 发生氧化还原反应的离子方程式为
发生氧化还原反应的离子方程式为  (已配平)。则物质M、N中氯元素的化合价分别为( )
(已配平)。则物质M、N中氯元素的化合价分别为( )
A . 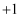 价、
价、  价
B .
价
B . 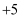 价、0价
C .
价、0价
C .  价、
价、  价
D . 0价、
价
D . 0价、  价
价
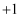 价、
价、  价
B .
价
B . 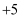 价、0价
C .
价、0价
C .  价、
价、  价
D . 0价、
价
D . 0价、  价
价
氦气的化学式是( )
A . H2
B . He
C . He2
D . Ar
高铁酸钠( )具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成
)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成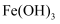 能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:
能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下: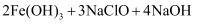
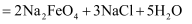 。下列说法错误的是( )
。下列说法错误的是( )
 )具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成
)具有很强的氧化性,能有效地杀灭水中的细菌和病毒,同时被还原成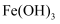 能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下:
能高效地除去水中的悬浮物,是一种新型高效水处理剂。其制备方法如下: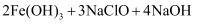
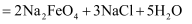 。下列说法错误的是( )
。下列说法错误的是( )
A .  中
中 元素显+6价
B . 碱性条件下
元素显+6价
B . 碱性条件下 氧化性强于
氧化性强于 C . 每生成
C . 每生成 转移
转移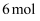 电子
D . 在水处理中,
电子
D . 在水处理中, 兼具消毒和净水两种功能
兼具消毒和净水两种功能
 中
中 元素显+6价
B . 碱性条件下
元素显+6价
B . 碱性条件下 氧化性强于
氧化性强于 C . 每生成
C . 每生成 转移
转移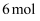 电子
D . 在水处理中,
电子
D . 在水处理中, 兼具消毒和净水两种功能
兼具消毒和净水两种功能
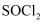 (
(  )极易水解,主要用于制备酰基氯化物。下列关于
)极易水解,主要用于制备酰基氯化物。下列关于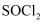 说法错误的是( )
说法错误的是( )
A . 既有氧化性又有还原性
B . 遇水反应生成 和
和 C . 可用作由
C . 可用作由 制取无水
制取无水 的脱水剂
D .
的脱水剂
D . 
 和
和 C . 可用作由
C . 可用作由 制取无水
制取无水 的脱水剂
D .
的脱水剂
D . 
国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿等均可有效灭活病毒。对于上述化学药品,下列说法错误的是( )
A . CH3CH2OH能与水互溶
B . NaClO通过氧化灭活病毒
C . 过氧乙酸相对分子质量为76g/mol
D . 氯仿的化学式为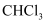
某FexNy的晶胞如图1所示,晶胞边长为apm,Cu可以完全替代该晶体中a位置Fe或b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。下列说法正确的是( )

A . 该FexNy的化学式为Fe2N
B . 与N等距且最近的N为8个
C . 两个a位置Fe的最近距离为 apm
D . 其中较稳定的Cu替代型产物的化学式为Fe3CuN
apm
D . 其中较稳定的Cu替代型产物的化学式为Fe3CuN
 apm
D . 其中较稳定的Cu替代型产物的化学式为Fe3CuN
apm
D . 其中较稳定的Cu替代型产物的化学式为Fe3CuN
下列物质中,氯元素化合价最高的是( )
A . Cl2O
B . NH4Cl
C . NaClO4
D . KClO3
最近更新



