物质的量与其浓度和气体摩尔体积的综合应用 知识点题库
在标准状况下,将22.4L HCl完全溶于1L水中(水的密度近似为1g/mL),溶液的密度为ρ g/cm3 , 溶液的体积为V mL,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是( )
①w= ×100% ②c=1mol•L﹣1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④所得溶液中含有NA个HCl分子.
×100% ②c=1mol•L﹣1 ③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w ④所得溶液中含有NA个HCl分子.
A . 全部
B . ①③④
C . ①③
D . 只有①
标准状况下①13.44L CH4②1molHCl分子③27.2gH2S ④2.408×1023个NH3分子。则( )
A . 体积:②>③>④>①
B . 密度:②>③>④>①
C . 质量:②>③>④>①
D . H原子个数:①>③>②>④
下列两种气体的分子数一定相等的是( )
A . 质量相等、体积不等的CO和N2
B . 等温、等体积的O2和N2
C . 等压、等密度的CO和N2
D . 等压、等体积的O2和N2
将40 g氢氧化钠溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为( )
A . 0.1 mol·L-1
B . 0.5 mol·L-1
C . 4 mol·L-1
D . 1 mol·L-1
设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A . 1molOH-所含的质子数和电子数都为10NA
B . NA个微粒就是6.02×1023个微粒
C . 0.1mol硫酸中含有的原子总数为0.7NA
D . 1molCO所含电子数是28NA
下列说法中正确的是( )
A . 22.4L CO2与足量Na2O2反应转移的电子数为NA
B . 1mol·L-1的NaOH溶液中含Na+数目为NA
C . 78gNa2O2晶体中含有的阴离子数目为2NA
D . a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加ag
中国药学家屠呦呦因发现青蒿素开创了治疗疟疾的新方法,荣获了诺贝尔奖。第十三届全国人民代表大会常务委员会第十三次会议决定授予屠呦呦“共和国勋章”,表彰他及其团队为新中国建设和发展作出的杰出贡献。已知青蒿素的分子式为C15H22O5 , 下列有关说法正确的是( )
A . 青蒿素的摩尔质量为282g/mol
B . 青蒿素中C,H,O的质量之比为15:22:5
C . 标准状况下,1mol青蒿素的体积约为22.4L
D . 1mol青蒿素中含11molH2
-
(1) 等质量的O2、CH4、H2的物质的量之比为,标准状况下,体积之比为,密度之比为。
-
(2) 44.4g某二价金属氯化物(ACl2)中含有0.8molCl- , 则ACl2的摩尔质量是,A的相对原子量是,ACl2的化学式是。
-
(3) 同温同压下,同体积的气体X2和气体Y2完全反应生成气体Z,且反应前后气体体积不变,则Z的化学式为。
设NA为阿伏加德罗常数,下列说法正确的是( )
A . 22.4LN2所含氮分子数为NA
B . 18g水所含分子数为NA
C . 16gCH4所含原子数为NA
D . 23g金属钠所含电子数为NA
用NA表示阿伏加德罗常数的值,下列判断错误的是( )
A . 常温常压下3.2 g O2和O3所含的原子数为0.2NA
B . 非标准状况下,44 g CO2所含的氧原子数目为2NA
C . 室温下,1mol H2中含有质子数为2NA
D . 1mol·L-1的K2SO4溶液中钾离子数为2NA
据解放网-新闻晚报报道:2006年08月03日凌晨,一条满载200吨浓硫酸的货船在京杭大运河浙江余杭段塘栖武林头检查站南1500米处发生泄漏并搁浅,附近运河水域发生部分污染,京杭运河余杭段及上游河段被迫紧急封航12小时。下列有关硫酸叙述正确的是( )
A . 1 mol H2SO4的质量为98 g·mol-1
B . H2SO4的摩尔质量为98 g
C . 98 g H2SO4含有NA个H2SO4分子
D . 6.02×1023个H2SO4分子的质量为9.8 g
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 80gNH4NO3晶体中N原子数为NA
B . 4.0gNaOH与MgO的混合物中含有的质子数目为2NA
C . 1mol·L-1Ba(OH)2溶液中,OH-数为2NA
D . 5.6gFe与标准状况下1.12LCl2完全反应,转移电子数约为0.3NA
一种无色气体 100mL,由 NH3、NO、CO2 所组成,将此无色气体通过浓硫酸的洗气瓶后, 发现气体减少了 30mL。剩余气体继续通过 Na2O2 固体后,发现气体变成红棕色,再将该气体通入盛满水倒立于水槽中的试管内,发现试管内水位上升,最后试管内充满液体。则原混合气体中 NH3、NO、CO2 气体的体积比为( )
A . 15∶14∶21
B . 5∶8∶12
C . 10∶14∶21
D . 30∶28∶23
某(NH4)2CO3和(NH4)2SO4的固体混合物含氮量为23.3%。
-
(1) 取9.0g该混合物,加入足量浓NaOH溶液,加热,产生的气体在标准状况下体积为L(保留2位小数)。
-
(2) 向上述反应后的混合溶液中再加入足量稀盐酸,产生560mL气体(标准状况)。列式计算原固体混合物中(NH4)2CO3和(NH4)2SO4的物质的量之比。
多伦多大学EdwardSargent教授团队研发了一种将乙烯高效转化为环氧乙烷的电化学合成方法。反应在KCl电解液的流动池中进行,示意图如图。电解结束后,将阴阳极电解液输出混合,便可生成环氧乙烷。下列说法正确的是( )

A . 泡沫镍电极连接电源负极
B . 铂箔电极附近溶液pH下降
C . 该过程的总反应为CH2=CH2+HOCl→  +HCl
D . 当电路中通过1mol电子时,铂箔电极上会产生11.2L气体(标准状况)
+HCl
D . 当电路中通过1mol电子时,铂箔电极上会产生11.2L气体(标准状况)
将5.6 g Fe全部溶于200 mL一定浓度的硝酸溶液中,得到标准状况下的气体2.24 L(该气体可能为NO或NO2或NO和NO2的混合气体),又测得反应后溶液中H+的物质的量浓度为0.2 mol·L-1(设反应前后溶液体积的变化忽略不计)。下列说法正确的是( )
A . 2.24 L气体是NO和NO2的混合气体
B . 反应后的溶液中含有Fe2+和Fe3+
C . 反应后的溶液中c( 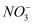 )=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
)=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
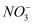 )=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
)=1.5 mol·L-1
D . 反应后的溶液最多还能再溶解3.64 g Fe
回答下列问题:
-
(1) 0.3mol NH3分子中所含原子数与mol H2O分子中所含原子数相等。
-
(2) 含有 NA个氦原子的氦气在标准状况下的体积约为L
-
(3) 物质的量浓度相同时,碳酸钠溶液的pH比碳酸氢钠的(填“大”或“小”)
-
(4) 氢氧化钡与稀硫酸反应的离子方程式。
用 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
 表示阿伏加德罗常数的数值,下列说法正确的是( )
表示阿伏加德罗常数的数值,下列说法正确的是( )
A . 常温常压下,48g  和
和 含有的氧原子数均为3
含有的氧原子数均为3 B . 标准状况下,22.4L
B . 标准状况下,22.4L  含有的分子数为
含有的分子数为 C . 标准状况下,11.2L
C . 标准状况下,11.2L 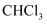 中含有
中含有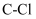 键的数目为0.5
键的数目为0.5 D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
 和
和 含有的氧原子数均为3
含有的氧原子数均为3 B . 标准状况下,22.4L
B . 标准状况下,22.4L  含有的分子数为
含有的分子数为 C . 标准状况下,11.2L
C . 标准状况下,11.2L 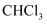 中含有
中含有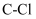 键的数目为0.5
键的数目为0.5 D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
D . 2.7g铝与足量氢氧化钠溶液反应转移的电子数为
反应 中,在标准状况下,当反应转移电子数为
中,在标准状况下,当反应转移电子数为 个时,产生的气体体积为( )
个时,产生的气体体积为( )
 中,在标准状况下,当反应转移电子数为
中,在标准状况下,当反应转移电子数为 个时,产生的气体体积为( )
个时,产生的气体体积为( )
A . 11.2
B . 22.4L
C . 5.6L
D . 2.8L
 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A . 3.2g 和
和 的混合物中氧原子数目为0.2
的混合物中氧原子数目为0.2 B . 0.1mol/L
B . 0.1mol/L 溶液中含
溶液中含 数目为0.1
数目为0.1 C . 将7.1g
C . 将7.1g 通入水中转移电子数目为0.1
通入水中转移电子数目为0.1 D . 标准状况下,2.24L三氯甲烷中含共价键数目为0.4
D . 标准状况下,2.24L三氯甲烷中含共价键数目为0.4
 和
和 的混合物中氧原子数目为0.2
的混合物中氧原子数目为0.2 B . 0.1mol/L
B . 0.1mol/L 溶液中含
溶液中含 数目为0.1
数目为0.1 C . 将7.1g
C . 将7.1g 通入水中转移电子数目为0.1
通入水中转移电子数目为0.1 D . 标准状况下,2.24L三氯甲烷中含共价键数目为0.4
D . 标准状况下,2.24L三氯甲烷中含共价键数目为0.4
最近更新



