有关过量问题的计算 知识点题库
-
(1) 由于CO2通入量不同,所得到的白色固体的组成也不同,试写出所有可能的组成,填入下表,可以不填满.
可能情况
①
②
③
④
⑤
组成物质
-
(2) 若通入CO2气体为2.24L(标准状况下),得到11.9g 的白色固体.请通过计算确定此白色固体组成的物质是 ;所用的KOH溶液的物质的量浓度为 mol/L.
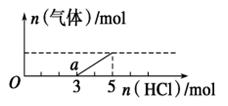
分别取等物质的量浓度的氢氧化钠溶液各100mL,再通入一定量的CO2 , 随后分别各取20mL溶液,向其中逐滴滴入0.2mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如图(分A、B两种情况):

-
(1) 在A情况下,溶质是(填化学式) ,其物质的量之比为
-
(2) 在B情况下,溶质是(填化学式) ,其物质的量之比为
-
(3) 原氢氧化钠溶液的物质的量浓度为
-
(1) 某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式。
②写出过量铁与稀硝酸反应的离子方程式。
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比。
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为g。
-
(2) 饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式: Al+NO3-+OH-=AlO2-+N2↑+。
②上述反应中,还原剂与还原产物的物质的量之比是 ,反应中转移电子0.3mol,标准状况下生成N2是mL。

下列分析错误的是( )
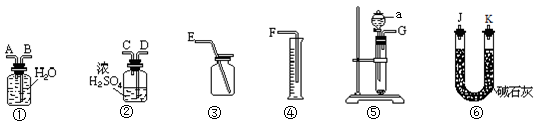
请回答下列问题:
-
(1) 装置⑤中仪器a的名称是。
-
(2) 用上述装置可以组装一套最简单的测定过氧化钠样品纯度的实验装置。
Ⅰ.该实验装置的组合是(填字母)。
a. ①④⑤
B. ①③⑤
C. ②④⑤
D. ③⑤⑥
Ⅱ.所选用装置的连接顺序应是(填各接口的字母,连接胶管省略)。
-
(3) 写出实验中Na2O2发生反应的化学方程式。
-
(4) 用上述实验后所得溶液配制成浓度为1.0mol/L的溶液,回答下列问题。
①向400mL该溶液中通入0.3mol CO2 , 则所得溶液中HCO3–和CO32–的物质的量浓度之比约为。
A.1:3 B.1:2 C.2:1 D.3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,下列选项中不能准确测定混合物中Na2CO3质量分数的是。
a. 取a g混合物充分加热,在干燥器中冷却至室温,减重b g
b. 取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
c. 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
d. 取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答下列问题:
-
(1) 实验中不考虑铁架台等夹持仪器外,需要的仪器有(填序号),还缺少的仪器有(填名称)。
A.托盘天平(带砝码,镊子)
B.滴定管 C.100mL容量瓶
D.烧杯E.漏斗 F.锥形瓶 G.玻璃棒 H.烧瓶
-
(2) 实验中KMnO4溶液应装在式滴定管中,滴定终点的判断依据是
-
(3) 若在滴定前没有用amol·L-1的KMnO4溶液对滴定管进行润洗,则所测得的x值会(偏大、偏小、无影响)。
-
(4) 若滴定终点读数时目光仰视,则计算出的x值可能(填偏大、偏小、无影响)。
-
(5) 滴定过程中用去V mL a mol·L-1的KMnO4溶液,则所配制的草酸的物质的量浓度为mol·L-1 。
①过量的锌与18 mol·L—1的硫酸反应;
②过量的氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2;
④过量铜与浓硫酸;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与块状石灰石
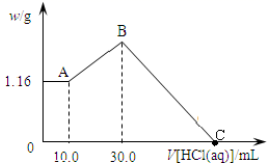
请回答:
①A点溶液中溶质有(填化学式);
②写出加入盐酸体积由10.0mL到30.0mL发生反应的离子方程式;
③原混合物中MgCl2质量是, AlCl3物质的量是, NaOH质量是。
④C点消耗盐酸的体积为mL。
 B .
B .  C .
C .  D .
D . 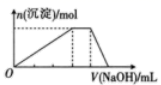
①Na2CO3与稀盐酸;②Fe与稀HNO3;
③Ca(HCO3)2溶液与Ca(OH)2溶液;④FeBr2溶液与Cl2;
⑤Fe与Cl2



