有关过量问题的计算 知识点题库
今有120mL0.20mol/L Na2CO3的溶液和某浓度的200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
A . 1.5 mol/L
B . 2.0mol/L
C . 0.18 mol/L
D . 0.24mol/L
等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是( )
A . 甲、乙中都是铝过量
B . 甲中铝过量,乙中碱过量
C . 甲中酸过量,乙中铝过量
D . 甲中酸过量,乙中碱过量
向10mL 1.5mol/L的硫酸铝溶液加入30mL NaOH溶液,充分反应后得到1.56g沉淀,则NaOH溶液的物质的量浓度是( )
A . 1mol/L
B . 2mol/L
C . 5mol/L
D . 3.3mol/L
向1L 0.1mol/L的AlCl3溶液中加入1mol/L的NaOH溶液,若得到3.9g沉淀,则加入的NaOH溶液的体积
将标准状况下一定体积的CO2缓缓通入体积为V L NaOH溶液中,充分反应后,在减压低温的条件下蒸发溶液,得到白色固体.
-
(1) 由于CO2通入量不同,所得到的白色固体的组成不同,推断并写出各种可能组成的化学式:(可以不填满,也可以添加序号)
① ;② ;③ ;
④ ;⑤;⑥ .
-
(2) 按反应的先后顺序,写出各步反应的离子方程式:
-
(3) 若反应中CO2和NaOH均无剩余,反应后向溶液中加入过量的澄清石灰水生成m1g白色沉淀.
①根据以上数据,能否推理计算出标准状况下CO2的体积?若能,用代数式表示CO2的体积V(CO2)= .若不能,理由是 .
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示NaOH溶液的浓度c(NaOH)= . 若不能,理由是
将标准状况下1.12 LCO2通入含有2 g NaOH的水溶液中,完全反应并得到2 L溶液,则
对于该溶液表述正确的是( )
A . CO2和NaOH完全反应生成碳酸氢钠
B . 反应所得溶液呈酸性
C . HCO的电离程度大于HCO3-的水解程度
D . 存在的平衡体系只有:HCO3-+H2O 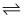 H2CO3+OH- , HCO3-
H2CO3+OH- , HCO3- 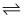 H++CO32-
H++CO32-
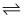 H2CO3+OH- , HCO3-
H2CO3+OH- , HCO3- 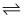 H++CO32-
H++CO32-
下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与盐酸 ⑤Na与O2。由于条件不同而能发生不同氧化还原反应的是( )
A . 只有③④
B . 只有①②
C . 只有①③⑤
D . 只有①③④⑤
下列反应中,调节反应物用量或浓度不会改变反应产物的是( )
A . CO2通入石灰水
B . AlCl3溶液中滴入NaOH溶液
C . NaHCO3溶液中滴入稀盐酸
D . 硫酸中加入锌粉
氯气和二氧化氮气体在室温下可以化合生成一种新的气态化合物A,为了测定A的组成进行以下实验,取Cl2、NO2混合气总体积5L,测定反应后所得气体体积随Cl2在原混合气体中所占体积分数x的变化而变化的规律.实验测知当Cl2所占体积分数为0.2或0.6时,反应后的总体积均为4L.
-
(1) 通过分析和计算求得化合物A的化学式为,发生反应的化学方程式.
-
(2) 试讨论当x的取值范围不同时,反应后总体积V随x变化的函数关系.
有50 mL NaOH溶液,向其中逐渐通入一定量的CO2 , 随后取此溶液10 mL将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的HCl溶液,产生CO2气体的体积(标准状况)与所加入盐酸的体积之间的关系如下图所示:

-
(1) 甲溶液中的溶质是,其物质的量之比为。
-
(2) 乙溶液中的溶质是,在标准状况下吸收CO2气体的体积为。
-
(3) 原NaOH溶液的物质的量浓度为。
电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝缘板没入500mL某浓度FeCl3溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余;将固体滤出并从滤液中取出20.00mL,向其中滴入2.00mol/LAgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
-
(1) 原FeCl3溶液的物质的量浓度是多少。
-
(2) 假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少应当大于多少。
下列说法正确的是( )
A . 1L0.1mol·L-1的氨水中含有的NH3与NH4+之和为0.1NA
B . 标准状况下,2.24LCCl4中含有的C—Cl键数为0.4NA
C . l0.0mL18 mol·L-1浓硫酸与足量铜反应,生成SO2的分子数为0.09NA
D . 标准状况下,Na2O2与足量CO2反应生成2.24LO2 , 转移电子数为0.2NA
向 100mL Na2CO3 与 NaAlO2 的混合溶液中逐滴加入 1mol/L 的盐酸,测得溶液中的 CO32-、HCO3- 、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。下列说法正确的是( )

A . 原 混 合 溶 液 中 的 n (CO32-): n (AlO2-)=2:1
B . a 点溶液中:c(HCO3-)+c(H2CO3)+c(H+)=c(OH-)
C . b 点溶液中离子浓度顺序为:c(Cl-)>c(HCO3-)>c(CO32-)>c(OH- )
D . d→e 的过程中水的电离程度逐渐减小
在一密闭气缸内,用不漏气的可滑动的活塞隔开,左边充有氮气,右边充有氢气和氧气的混合体,平衡时活塞恰好在气缸的中央,如图所示。

在室温下,将右边的混合气体点燃,反应后冷却至室温,活塞最终静止在气缸的位置如图所示,则原混合气体中氢气与氧气的体积比可能是( )
①5:4 ②4:5 ③7:2 ④2:7
A . ①④
B . ②③
C . ①③
D . ②④
用  溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()
溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()
 溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()
溶液腐蚀印刷电路板上的铜,所得溶液中加入过量的铁粉,充分反应后,最终溶液中的金属阳离子()
A . 只含 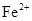 B . 含
B . 含 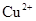 和
和 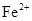 C . 含
C . 含 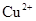 和
和 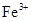 D . 只含
D . 只含 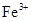
下列物质相互作用时,生成物与反应物的量或者反应条件无关的是( )
A . 碳酸氢钠与石灰水
B . 碳酸钠与盐酸
C . 钠与水
D . 钠与氧气
下列实验过程中产生的现象与对应的图象不相符的是( )
A .  向NaOH溶液中滴加AlCl3溶液至过量
B .
向NaOH溶液中滴加AlCl3溶液至过量
B .  向NaAlO2溶液中滴加盐酸至过量
C .
向NaAlO2溶液中滴加盐酸至过量
C .  向Na2CO3溶液中逐滴加入稀盐酸
D .
向Na2CO3溶液中逐滴加入稀盐酸
D .  向含有Mg2+和Al3+的溶液中加入NaOH溶液至过量
向含有Mg2+和Al3+的溶液中加入NaOH溶液至过量
 向NaOH溶液中滴加AlCl3溶液至过量
B .
向NaOH溶液中滴加AlCl3溶液至过量
B .  向NaAlO2溶液中滴加盐酸至过量
C .
向NaAlO2溶液中滴加盐酸至过量
C .  向Na2CO3溶液中逐滴加入稀盐酸
D .
向Na2CO3溶液中逐滴加入稀盐酸
D .  向含有Mg2+和Al3+的溶液中加入NaOH溶液至过量
向含有Mg2+和Al3+的溶液中加入NaOH溶液至过量
取A、B两份物质的量浓度相等的NaOH溶液,体积均为50 mL,分别向其中通入一定量的CO2后,再分别稀释到100 mL,在稀释后的溶液中分别逐滴加0.1 mol/L的盐酸,产生的CO2的体积(标准状况)与所加盐酸的体积关系如图所示:

-
(1) 原NaOH溶液的物质的量浓度。
-
(2) B份混合溶液与盐酸反应产生气体的最大体积为mL(标准状况)。
把一定量的Fe和Cu的混和粉末投入到FeCl3溶液中,充分反应后,下列情况不可能的是( )
A . Fe 和 Cu都剩
B . Fe 和 Cu 都不剩
C . Fe 剩余,Cu无剩余
D . Cu剩余,Fe无剩余
向200mL的NaOH和Na2CO3混合溶液中滴加0.1 mol/L稀盐酸,CO2的生成量与加入盐酸的体积的关系如图所示。下列判断正确的是( )

A . 0~a段只发生中和反应
B . 原混合液中NaOH 的物质的量浓度为 0.1mol/L
C . a=0.2
D . 原混合溶液中 NaOH与 Na2CO3的物质的量之比为1∶2
最近更新



