有关混合物反应的计算 知识点题库
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如下图所示.试回答:
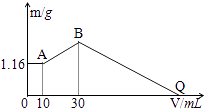
-
(1) A点的沉淀物的化学式为,B点的沉淀物的化学式为.
-
(2) 原混合物中MgCl2的质量是 g,AlCl3的质量是 g,NaOH的质量是g.
-
(3) Q点HCl溶液加入量是 mL.
现有AlCl3和MgSO4混合溶液,向其中不断加入0.1mol/L 的NaOH溶液,得到沉淀的量与加入NaOH溶液的体积如图所示,原溶液中Cl﹣与SO42﹣的物质的量之比为( )
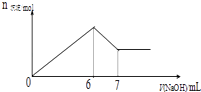
A . 2:1
B . 2:3
C . 6:1
D . 3:1
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A . 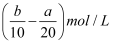 B . (2b﹣a)mol/L
C .
B . (2b﹣a)mol/L
C . 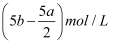 D . (10b﹣5a)mol/L
D . (10b﹣5a)mol/L
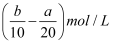 B . (2b﹣a)mol/L
C .
B . (2b﹣a)mol/L
C . 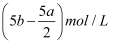 D . (10b﹣5a)mol/L
D . (10b﹣5a)mol/L
盛有NO和NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.
-
(1) 写出有关反应的化学方程式.
-
(2) 原混合气体中NO和NO2的体积比是多少?
下列各组有机物,无论它们以何种物质的量的比例混和,只要总物质的量一定,则在完全燃烧时,消耗氧气的量为一定值的是( )
A . C2H6和C3H8
B . C5H10和C6H6
C . C2H6O和C2H4O2
D . C3H6和C3H8O2
将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体.将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为( )
A . 2:1:1
B . 1:1:2
C . 1:2:1
D . 4:3:3
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为( )
A . 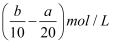 B . (2b﹣a)mol/L
C .
B . (2b﹣a)mol/L
C . 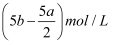 D . (10b﹣5a)mol/L
D . (10b﹣5a)mol/L
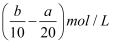 B . (2b﹣a)mol/L
C .
B . (2b﹣a)mol/L
C . 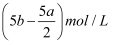 D . (10b﹣5a)mol/L
D . (10b﹣5a)mol/L
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是( )
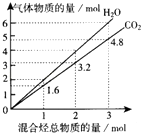
A . 该混合气体中一定含有乙烯
B . 该混合气体一定含有甲烷和乙炔
C . 在110℃条件下,该混合气体与氧气混合,总混合气燃烧前后体积不变
D . 若混合气体由CH4和C2H4组成,则其体积比为1:3
将氧化铁和氧化铜的混合物a g,加入200mL1mol•L﹣1的硫酸溶液中,恰好完全溶解.若将等质量这种混合物在氢气中加热并充分反应,冷却后剩余固体的质量为( )
A . 1.6 a g
B . 3.2a g
C . (a﹣3.2)g
D . (a﹣1.6)g
某硫酸镁和硫酸铝的混合溶液中,c(Mg2+ )=2 mol·L-1 , c(SO42-)=6.5 mol·L-1 , 若将200 mL此混合液中的Mg2+和Al3+分离,至少应加入1.6 mol·L-1氢氧化钠溶液的体积是( )
A . 0.5 L
B . 1.625 L
C . 1.8 L
D . 2 L
向100mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法中不正确的是( )
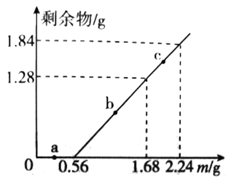
A . a点时溶液中阳离子为Cu²+、Fe²+和Fe3+
B . b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C . c点时溶液中溶质的物质的量浓度为0.5mol/L
D . 原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1:1
苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
![]() +KMnO4→
+KMnO4→ 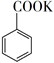 + MnO2
+ MnO2 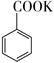 +HCl→
+HCl→ 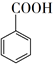 +KCl
+KCl
|
名称 |
相对分 子质量 |
熔点/℃ |
沸点/℃ |
密度/(g·mL−1) |
溶解性 |
|
甲苯 |
92 |
−95 |
110.6 |
0.867 |
不溶于水,易溶于乙醇 |
|
苯甲酸 |
122 |
122.4(100℃左右开始升华) |
248 |
—— |
微溶于冷水,易溶于乙醇、热水 |
实验步骤:①在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5 mL甲苯、100 mL水和4.8 g(约0.03 mol)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
②停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0 g。
③纯度测定:称取0. 122 g粗产品,配成乙醇溶液,于100 mL容量瓶中定容。每次移取25. 00 mL溶液,用0.01000 mol·L−1的KOH标准溶液滴定,三次滴定平均消耗21. 50 mL的KOH标准溶液。
回答下列问题:
-
(1) 根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(填标号)。A . 100 mL B . 250 mL C . 500 mL D . 1000 mL
-
(2) 在反应装置中应选用冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是。
-
(3) 加入适量饱和亚硫酸氢钠溶液的目的是;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理。
-
(4) “用少量热水洗涤滤渣”一步中滤渣的主要成分是。
-
(5) 干燥苯甲酸晶体时,若温度过高,可能出现的结果是。
-
(6) 本实验制备的苯甲酸的纯度为;据此估算本实验中苯甲酸的产率最接近于(填标号)。
A.70% B.60% C.50% D.40%
-
(7) 若要得到纯度更高的苯甲酸,可通过在水中的方法提纯。
现有一份MgSO4和(NH4)2SO4的混合溶液,向该溶液中加入一定浓度的Ba(OH)2溶液,产生的沉淀质量(m)与加入Ba(OH) 2溶液的体积(V)关系如图。

-
(1) Ba(OH)2溶液的物质的量浓度为mol•L-1。
-
(2) 该混合溶液MgSO4和(NH 4)2SO4物质的量之比为。
向一定量的FeO、Fe、Fe3O4的混合物中加入200mL1mol·L-1的盐酸,恰好使混合物完全溶解,放出336mL(标准状况)的气体,在所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同的质量的此混合物,能得到铁的质量是 ( )
A . 11.2g
B . 5.6g
C . 2.8g
D . 无法计算
铜镁合金4.6 g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480 mL NO2气体和 336 mL N2O4气体(标准状况下),反应后的溶液中加足量NaOH溶液,生成沉淀的质量为( )
A . 8.51 g
B . 4.83 g
C . 8.31 g
D . 9.44 g
已知:2Fe+3Br2=2FeBr3 , Fe2+的还原性大于Br-。现有16.8 g铁和0.3 mol Br2反应后加入水得到澄清溶液后,通入a mol Cl2。则下列叙述错误的是( )
A . 当a=0.1时,发生的反应为2Fe2++Cl2=2Fe3++2Cl-
B . 当a=0.45时,发生的反应为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C . 若溶液中Br-有一半被氧化时,c(Fe3+)∶c(Br-)∶c(Cl-)=1∶1∶3
D . 当0<a<0.15时,始终有2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-)+c(Br-)+c(OH-)
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
-
(1) Ca元素在周期表中位置是,其原子结构示意图。
-
(2) Ca与最活跃的非金属元素A形成化合物D,D的电子式为,D的沸点比A与Si形成的化合物E的沸点。
-
(3) 配平用钙线氧脱鳞的化学方程式:P+FeO+CaO
 Ca3(PO4)2+Fe。
Ca3(PO4)2+Fe。
-
(4) 将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n , 则金属M为;检测Mn+的方法是(用离子方程式表达)。
-
(5) 取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),再向溶液中通入适量的CO2 , 最多能得到CaCO3g。
现有CuO和Fe2O3组成的混合物若干克,向其中加入一定浓度的硫酸溶液50.0mL,恰好完全反应。向反应后的溶液中不断加入铁粉,加入铁粉的质量与充分反应后剩余固体的质量关系如图所示。
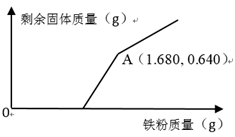
试计算:
-
(1) 固体混合物中CuO的质量分数为%;
-
(2) 硫酸溶液的物质的量浓度为mol/L
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入100mL 1mol/L 的盐酸,恰好使混合物完全反应,放出 11.2mL(标准状况)气体,所得溶液加入 KSCN 溶液不变红色。用足量的CO 在高温下还原相同质量的此混合物,所得铁的质量为( )
A . 2.8g
B . 11.2g
C . 5.6g
D . 无法计算
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份溶液中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体)。向另一份溶液中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示,下列分析或结果不正确的是( )
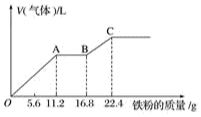
A . OA段产生的是NO,AB段的反应为 , BC段产生氢气
B . 原混合酸中硝酸的物质的量为0.4mol
C . 第二份溶液中最终溶质为
, BC段产生氢气
B . 原混合酸中硝酸的物质的量为0.4mol
C . 第二份溶液中最终溶质为 D . 取20mL原混合酸加水稀释至1L后溶液的
D . 取20mL原混合酸加水稀释至1L后溶液的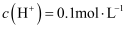
 , BC段产生氢气
B . 原混合酸中硝酸的物质的量为0.4mol
C . 第二份溶液中最终溶质为
, BC段产生氢气
B . 原混合酸中硝酸的物质的量为0.4mol
C . 第二份溶液中最终溶质为 D . 取20mL原混合酸加水稀释至1L后溶液的
D . 取20mL原混合酸加水稀释至1L后溶液的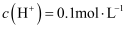
最近更新



