有关混合物反应的计算 知识点题库
1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A . 该合金中铜与镁的物质的量之比是2:1
B . 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C . NO2和N2O4的混合气体中,NO2的体积分数是80%
D . 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
将21.8g Na2O与Na2O2的混合物溶于足量水中,称得水溶液净重18.6g,则混合物中Na2O2和Na2O的质量之比为( )
A . 2:1
B . 78:31
C . 78:62
D . 39:62
将0.2mol两种气态烃组成的混合气完全燃烧后得到6.72升二氧化碳(标准状况下)和7.2克水,下列关于该混合烃说法正确的是( )
A . 一定有乙烯
B . 一定有甲烷
C . 一定没有甲烷
D . 可能有乙炔
将盛有N2和NO2(无N2O4 )混合气体的试管倒立于水中,经过足够长的时间后,试管内气体的体积缩小为原来的一半,则原混合气体中N2和NO2的体积比是( )
A . 1:1
B . 1:2
C . 1:3
D . 3:1
在铁与铜的混合物中,加入不足量的稀硝酸.反应后剩余金属m1g;再向其中加入一定量稀硫酸,充分振荡后,剩余金属m2g,则m1与m2之间的关系是( )
A . m1可能等于m2
B . m1一定大于m2
C . m1一定等于m2
D . ml可能大于m2
把一定量的Na2O2和NaHCO3的混合粉末分为两等份,将其中一份加入到100mL稀盐酸中恰好完全反应,生成的气体干燥后体积为2.24L(标况);再将此气体通入另一份混合物中,恰好完全反应后,得到O2 2.016L(标况),则加入稀盐酸的物质的量浓度是( )
A . 3.4mol/L
B . 0.2mol/L
C . 1.8mol/L
D . 3.6mol/L
将m g含氧化铁、氧化铜或氧化亚铁的样品投入到2L物质的量浓度为1mol/L的盐酸中恰好完全反应,若向等质量的该样品中通入足量的氢气并加热,充分反应后所得金属的质量是( )
A . (m﹣16)g
B . (m+16)g
C . (m﹣32)g
D . 16g
取钠﹣镁合金7.0克进行如下实验:

-
(1) 写出Mg在CO2中燃烧的化学方程式
-
(2) 向溶液1中加过量的NaOH溶液,发生反应的离子方程式为
-
(3) 写出合金的化学组成.
将14g铜银合金与足量某浓度的硝酸反应,使放出的气体与1.12L(标准状况)氧气混合恰好被水全部吸收生成硝酸,则合金中铜的质量为( )
A . 3.2g
B . 4.43g
C . 10.8g
D . 12.4g
下列各金属的混合物2.5g和足量的盐酸反应,放出的H2在标准状况下体积为2.24L,其中可能的是( )
A . Zn和Fe
B . Mg和Zn
C . Al和Mg
D . Cu和Fe
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是( )
A . 合金的熔点一般比组分金属低
B . 铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na)
C . 铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出
D . 若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小
分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份.
-
(1) 将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图.混合物中n[(NH4)2SO4]:n(NH4Cl)为.

-
(2) 另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl﹣=(溶液体积变化忽略不计).
将碳酸钠和碳酸氢钠的混合物21.0g加热到质量不再变化时,剩余物质的质量为14.8g,求原混合物中碳酸钠的质量分数( )
A . 20.0%
B . 38.7%
C . 50.0%
D . 81.3%
由锌、铁、铝、镁四种金属中的两种组成的混合物23g,与足量的盐酸反应产生的氢气标准状况下为22.4L,则两种金属组成的混合物可能是( )
A . 锌与镁
B . 铁与锌
C . 铝与铁
D . 镁与铁
下列说法不正确的是( )
A . 常温下,醋酸钠与醋酸的混合溶液pH=7,c(Na+)=c(CH3COO﹣)
B . 常温下,将pH=1的醋酸溶液稀释100倍后,水电离的c(H+)=10﹣11mol/L
C . 0.1 mol/L Na2CO3溶液中:c(OH﹣)=c(HCO3﹣)+c(H+)+2c(H2CO3)
D . 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3﹣)+c(OH﹣)+2c(CO32﹣)
铜是生物体必需的微量元素,也是人类最早使用的金属之一。铜的生产和使用对国计民生各个方面都产生了深远的影响。
-
(1) 为了保护环境和节约资源,通常先用H2O2和稀硫酸的混合溶液溶出废旧印刷电路板中的铜,最终实现铜的回收利用。写出H2O2和稀硫酸的混合溶液与金属铜反应的离子方程式:。
-
(2) 工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。该工艺的中间过程会发生反应:2Cu2O+Cu2S
 6Cu+SO2↑,该反应的氧化剂是;当生成19.2gCu 时,反应中转移的电子为 mol。
6Cu+SO2↑,该反应的氧化剂是;当生成19.2gCu 时,反应中转移的电子为 mol。
-
(3) 研究性学习小组用“间接碘量法”测定某试样中CuSO4·5H2O(不含能与I-反应的氧化性杂质)的含量。称取a g试样配成 100 mL 溶液,取出25.00 mL溶液,向其中滴加 KI 溶液后有白色沉淀生成(发生的反应为2Cu2++4I-=2CuI↓+I2);继续滴加 KI 溶液至沉淀不再产生,反应生成的 I2 与V mL c mol·L-1Na2S2O3溶液恰好完全反应(发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6)。则试样中CuSO4·5H2O的质量分数为。
已知:K3Fe(CN)6遇Fe2+生成蓝色沉淀。固体粉末M中可能含有Cu、FeO、Fe2O3、K2SO3、Na2CO3、KCl中的若干种为确定该固体粉末的成分,现取M进行下列实验,实验过程及现象如下:

下列有关说法正确的是( )
A . 固体中戊一定含有Fe2O3和CuO
B . 气体乙中一定含有CO2 , 可能含有SO2
C . 固体粉末M中一定含有KCl
D . 固体粉末M中一定含有Cu、FeO,可能含有Fe2O3
室温下,将100mL某盐酸和硫酸的混合溶液分成两等份。一份加入过量BaCl2溶液,充分反应后得沉淀2.33g;另一份加入50mL1.0mol·L-1NaOH溶液,充分反应后溶液的 c(OH-)=0.1mol·L-1(反应后溶液的体积为100mL)。试计算:
-
(1) 每份溶液中所含H2SO4的物质的量mol。
-
(2) 原混合溶液中盐酸的物质的量浓度mol·L-1
一定条件下,将3.52g铜和铁的混合物溶于30mL一定浓度的热硝酸中,恰好完全反应,得到NO和NO2的混合气体0.08mol,且所得溶液不能使酸性高锰酸钾溶液褪色。向反应后的溶液中加入1mol∙L-1的NaOH溶液,当金属离子恰好全部沉淀时得到6.24g沉淀。该硝酸的浓度为( )
A . 2.4mol∙L-1
B . 5.3mol∙L-1
C . 7.2mol∙L-1
D . 8mol∙L-1
工业上,通过丁烷裂解可以获得乙烯和丙烯等化工原料:
① ;
;
② 。
。
-
(1) 甲烷、乙烷、丁烷互为(填“同系物”或“同分异构体”);丙烯和乙烯均能与
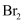 发生加成反应,标准状况下,33.6L由丙烯和乙烯组成的混合气体与足量的溴水反应,最多消耗mol
发生加成反应,标准状况下,33.6L由丙烯和乙烯组成的混合气体与足量的溴水反应,最多消耗mol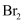 ;若将28g由丙烯和乙烯组成的混合气体置于空气中完全燃烧,则消耗mol
;若将28g由丙烯和乙烯组成的混合气体置于空气中完全燃烧,则消耗mol 。
。
-
(2) 向一体积为2L的恒容密闭容器中充入2mol丁烷,在一定温度和催化剂作用下发生上述2个反应,测得丁烷、丙烯的物质的量与时间关系如图所示。

①下列情况表明上述反应达到平衡状态的是(填标号)。
A.混合气体密度不随时间变化 B.混合气体平均摩尔质量不随时间变化
C.混合气体总压强不随时间变化 D.混合气体中碳原子总数不随时间变化
②
 内,乙烷的平均反应速率为
内,乙烷的平均反应速率为 。
。③在该条件下,丁烷的平衡转化率为。
④平衡体系中,
 。
。
最近更新



