复杂化学式的确定 知识点题库
某含铬[Cr2O72-] 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到n molFeO·FeyCrxO3 . 不考虑处理过程中的实际损耗,下列叙述错误的是 ( )
A . 消耗硫酸亚铁铵的物质量为n(2-x)mol
B . 处理废水中Cr2O72-的物质量为0.5nxmol
C . 反应中发生转移的电子数为3nx mol
D . 在FeO·FeyCrxO3中3x=y
某种盐可表示为:[xFeSO4•yAl2 (SO4)3•24H2O](其摩尔质量为 926g•mol﹣1),常用于制备高效的复合型高效混凝剂.其组成可通过下列实验测定.
①取一定质量的上述盐样品,准确配成100mL溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤,干燥至恒 重,得到白色固体4.660g.
③再量取25.00mL溶液A,滴加适量稀硫酸,用0.1000mol•L﹣1 KMnO4溶液滴定至终点,生成Mn2+ , 消耗KMnO4溶液10.00mL.
-
(1) 在25.00mL式样中,n(SO42﹣)=mol,n(Fe2+)= mol
-
(2) 铁明矾的化学式为
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl•xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、Al2O3、HCl和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去).

-
(1) Mg2Al(OH)6Cl•xH2O热分解的化学方程式为.
-
(2) 若只通过测定装置C、D的增重来确定x,则装置的连接顺序为按气流方向,用接口字母表示),其中C的作用是.装置连接后,首先要进行的操作名称是.
-
(3) 加热前先通过N2排尽装置中的空气,反应完成后,再持续通入N2的作用是.
-
(4) 完全分解后测得C增重3.65g、D增重9.90g,则x=.
[化学-选修3:物质结构与性质]固体电解质有广泛的用途。研究发现,晶体中有特殊结构为离子(如Li+)提供快速迁移的通道或者有“点缺陷”。都能使其具有导电潜力,比如:图(a)所示的锂超离子导体Li3SBF4和图(b)所示的有“点缺陷”的NaCl。

根据所学知识回答下列问题:
-
(1) 在变化“Cl+e-→Cl-”过程中,所得电子填充在基态 Cl的能级,此过程会 (填“吸收”或“释放”)能量。
-
(2) BF4-中B的杂化形式为,其等电子体为(任写一种)。与其VSEPR模型相同,且有l对孤电子对的相对分子质量最小的分子是。
-
(3) 图(a)所示晶胞中Li+位于位置;若将晶体中BF4-换成F- , 导电能力会明显降低,原因是。
-
(4) 图(6)中,若缺陷处填充了Na+ , 则它(填“是”或“不是”) NaCl的晶胞,在NaCl晶体中,Na+填充在Cl-堆积而成的面体空隙中。
-
(5) 有人认为:高温下有“点缺陷”的NaCl晶伙导电性增照是由于Na+迁移到另一空位而造成。其中Na+经过一个由3个Cl-组成的最小三角形窗孔(如图c所示)。已知晶胞参数a=564 pm,r(Na+)=116pm, r(Cl-)=167 pm,通过计算三角形窗孔半径,判断该认识是否正确。。(已知:
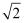 ≈1.414,
≈1.414, 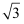 ≈1.732)
≈1.732)
氯和钾与不同价态的铜可生成两种化合物,这两种化合物都可用于催化乙炔聚合,其阴离子均为无限长链结构(如图),已知其中一种化合物的化学式为KCuCl3 , 下列说法中错误的是( )

A . a位置上Cl原子的杂化轨道类型为sp3
B . 铜在周期表中位于d区
C . 另一种的化学式为K2CuCl3
D . 该物质中存在配位键
碱式碳酸铜表示为:xCuCO3·yCu(OH)
2·zH2O,测定碱式碳酸铜组成的方法有多种。
采用氢气还原法,请回答如下问题:
-
(1) xCuCO3·yCu(OH) 2·zH2O与氢气反应的化学方程式
-
(2) 下列所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→()()→()()→()()→()()→()()→(l)

-
(3) 23.9g某碱式碳酸铜样品,充分反应后得到12.8g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为 g,化学式为。
5.56 g FeSO4·7H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,

下列说法不正确的是( )
A . 温度为78℃时固体物质M的化学式为FeSO4·4H2O
B . 取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
C . 在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O  FeSO4+H2O
D . 温度为159℃时固体N的化学式为FeSO4·2H2O
FeSO4+H2O
D . 温度为159℃时固体N的化学式为FeSO4·2H2O
 FeSO4+H2O
D . 温度为159℃时固体N的化学式为FeSO4·2H2O
FeSO4+H2O
D . 温度为159℃时固体N的化学式为FeSO4·2H2O
在由Na2S、Na2SO3、Na2SO4组成的固体混合物中,已知S的质量分数为25.6%,则氧的质量分数为( )
A . 36.8%
B . 37.6%
C . 51.2%
D . 无法计算
某化合物 A 由三种常见的元素组成,可以发生如下转化(气体体积已换算为标准状况下)

已知:气体B在标准状况下的密度l.96g•L-1 , 请回答:
-
(1) B的化学式为
-
(2) A的组成元素
-
(3) 已知A的阴离子结构与气体B相同, 请画出该阴离子的电子式
-
(4) 写出A 与稀盐酸反应的化学方程式
为探究某矿物固体X(仅含4种短周期元素)的组成和性质,其中固体乙可制光导纤维。现设计并完成如下实验:

请回答:
-
(1) X除了含有H、O元素以外还含有。
-
(2) 固体丙的用途。
-
(3) X的化学式是。
-
(4) 固体乙与NaOH溶液反应的离子方程式是。
已知:化合物A 和 B 均是由四种短周期元素组成的离子化合物, 且阳离子相同,A中阴阳离子个数比为1 : 1;气体甲由三种元素组成,标况下密度为2.68g•L-1 ,且分子中各原子最外层电子满足8 电子 ;乙和丙为'常见气体,均能使澄清石灰水变浑浊,丙能使品红溶液褪色;气体丁能使湿润的红色石蕊试纸变蓝。化合物A 按如下流程进行实验。

请回答
-
(1) 气体甲的电子式 。
-
(2) 气体丙通入足量硝酸钡溶液中,发生反应的离子方程式为。
-
(3) 检验A的水溶液中所含阴离子的实验方法为。
-
(4) 气体甲和气体丙在一定条件下 (填 “可能” 或“不可能”) 发生氧化还原反应,若可能请写出你认为合理的化学方程式,若不可能请说明你的理由。
为探究某铜的硫化物的组成,取一定量的硫化物在氧气中充分灼烧,将生成的气体全部通入盛有足量的H2O2和BaCl2的混合液中,得到白色沉淀11.65g;将灼烧后的固体(仅含铜与氧2种元素)溶于过量的H2SO4中,过滤,得到1.60g红色固体,将滤液稀释至150mL,测得c(Cu2+)=0.50 mol·Lˉ1。
已知:Cu2O+H2SO4=CuSO4+Cu+H2O
请计算:
-
(1) 白色沉淀的物质的量为mol。
-
(2) 该铜的硫化物中铜与硫的原子个数比N(Cu):N(S)=。
由三种元素组成的化合物A(摩尔质量  ),按如下流程进行实验。
),按如下流程进行实验。
 ),按如下流程进行实验。
),按如下流程进行实验。 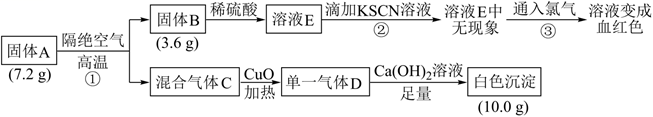
请回答:
-
(1) 化合物A含有的元素是。
-
(2) 写出①的化学方程式:。
-
(3) 写出③的离子方程式:。
-
(4) 若上述流程图中溶液E后的步骤改为:先通入氯气,后滴加
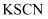 溶液,发现溶液变成血红色,则能否得出相同的结论,说明理由:。
溶液,发现溶液变成血红色,则能否得出相同的结论,说明理由:。
-
(5) 设计实验证明某混合气体中含有D和
 :。
:。
为确定某碱式碳酸镁  的组成,某同学取23.3g样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为10.0g,将产生的气体先通过足量98%的浓硫酸(
的组成,某同学取23.3g样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为10.0g,将产生的气体先通过足量98%的浓硫酸( 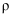 为
为  ),再通过足量的碱石灰,碱石灰质量增加8.8g。请计算:
),再通过足量的碱石灰,碱石灰质量增加8.8g。请计算:
 的组成,某同学取23.3g样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为10.0g,将产生的气体先通过足量98%的浓硫酸(
的组成,某同学取23.3g样品置于硬质玻璃管中充分灼烧至恒重,残留固体质量为10.0g,将产生的气体先通过足量98%的浓硫酸( 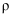 为
为  ),再通过足量的碱石灰,碱石灰质量增加8.8g。请计算:
),再通过足量的碱石灰,碱石灰质量增加8.8g。请计算:
-
(1) 98%的硫酸溶液物质的量浓度是;
-
(2) 根据实验测定的数据,求出碱式碳酸镁化学式中X、Y、Z的比值(要求写出计算过程)。
A、B、C、D、E、F均为中学里常见的物质,一定条件下存在如图所示转化。已知:A是不含结晶水的酸式盐,气体D在标准状况下的密度为2.857 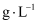 ,溶液E的焰色反应呈黄色。下列有关推断错误的是( )
,溶液E的焰色反应呈黄色。下列有关推断错误的是( )
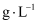 ,溶液E的焰色反应呈黄色。下列有关推断错误的是( )
,溶液E的焰色反应呈黄色。下列有关推断错误的是( ) 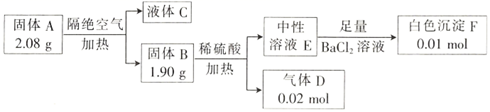
A . A的化学式为  B . 固体B具有还原性,是常用的抗氧化剂
C . 气体D能使品红溶液﹑酸性高锰酸钾溶液褪色
D . A,B,C,D,E,F均属于电解质
B . 固体B具有还原性,是常用的抗氧化剂
C . 气体D能使品红溶液﹑酸性高锰酸钾溶液褪色
D . A,B,C,D,E,F均属于电解质
 B . 固体B具有还原性,是常用的抗氧化剂
C . 气体D能使品红溶液﹑酸性高锰酸钾溶液褪色
D . A,B,C,D,E,F均属于电解质
B . 固体B具有还原性,是常用的抗氧化剂
C . 气体D能使品红溶液﹑酸性高锰酸钾溶液褪色
D . A,B,C,D,E,F均属于电解质
某化合物X由三种元素组成,某研究小组按如图流程探究其组成:

回答下列问题:
-
(1) 表现A具有氧化性的反应化学方程式为;固体B成分是。
-
(2) 写出X煅烧时反应的化学方程式,上述流程中转移电子的数目为。
-
(3) 红褐色沉淀灼烧后放在(填仪器名称)中冷却,然后用托盘天平称量,两次称量结果小于g可认为灼烧充分。
-
(4) 研究小组同学在最后所得的深蓝色溶液中缓慢加入乙醇,得到一种深蓝色晶体。经分析,该晶体是一种配合物,其化学式为;加入乙醇的作用是。
叶蛇纹石是一种富镁硅酸盐矿物[主要成分为Mg6(Si4O10)(OH)8 , 还含有Al2O3、Fe2O3、FeO等杂质],利用该矿物生产铁红(Fe2O3)和碱式碳酸镁的工艺流程如图所示:

回答下列问题:
-
(1) “转化”步骤中,温度不能过高的原因是。
-
(2) “调pH”时,产生滤渣2的反应离子方程式为。
-
(3) X通常选用(填化学式)。
-
(4) “沉镁”步骤中氨水加入的量不能太多,否则MgCO3·H2O的产率会降低,其原因是。
-
(5) 取9.1g碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O],高温分解后,测得生成3.3gCO2、4.0gMgO,化学式中z=写出由MgCO3·H2O生成产品的化学方程式:。
-
(6) 碱式碳酸镁常用作新型阻燃剂,试分析碱式碳酸镁能够阻燃的原因:。(写出一点即可)。
无机化合物A和NaH都是重要的还原剂,遇水都强烈反应。一定条件下,2.40gNaH与气体B反应生成3.90g化合物A和2.24L(已折算成标准状况)的H2.已知气体B可使湿润红色石蕊试纸变蓝。请回答下列问题:
-
(1) A的化学式是。
-
(2) NaH与气体B反应生成化合物A的化学方程式。
我国电动汽车产业发展迅猛,多种车型采用三元锂电池,其正极材料可表示为Li1-aNixCoyMnxO2其中Ni、Co.、Mn的化合价分别为+2、+3、+4,且x+y+z=1, 电池总反应为Li1-a NixCoyMnxO2 +LiaC6  LNixCoyMnxO2 +6C(石墨),其电池工作原理如图4所示,两板之间有一个允许特定离子X通过的隔膜。下列说法错误的是( )
LNixCoyMnxO2 +6C(石墨),其电池工作原理如图4所示,两板之间有一个允许特定离子X通过的隔膜。下列说法错误的是( )
 LNixCoyMnxO2 +6C(石墨),其电池工作原理如图4所示,两板之间有一个允许特定离子X通过的隔膜。下列说法错误的是( )
LNixCoyMnxO2 +6C(石墨),其电池工作原理如图4所示,两板之间有一个允许特定离子X通过的隔膜。下列说法错误的是( ) 
A . 允许离子X通过的隔膜属于阳离子交换膜
B . 充电时,外电路中流过0. 2mol电子,A极质量减少1. 4g
C . 在Li1-aNixCoyMnxO2材料中,若x :y:z=2 :3 :5,则a=0.3
D . 放电时,正极反应式为Li1-aNixCoyMnxO2+a Li++ae-=LiNxCoyMnxO2
联氨( )溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时,
)溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时, ,
,  。下列说法不正确的是( )
。下列说法不正确的是( )
 )溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时,
)溶于水后是一种二元弱碱,在水中的电离方式与氨相似。25℃时, ,
,  。下列说法不正确的是( )
。下列说法不正确的是( )
A .  的
的 溶液呈酸性
B .
溶液呈酸性
B .  的第二步电离方程式为
的第二步电离方程式为 C .
C .  与稀
与稀 中和生成的酸式盐的化学式为
中和生成的酸式盐的化学式为 D .
D .  的稀溶液中存在
的稀溶液中存在
 的
的 溶液呈酸性
B .
溶液呈酸性
B .  的第二步电离方程式为
的第二步电离方程式为 C .
C .  与稀
与稀 中和生成的酸式盐的化学式为
中和生成的酸式盐的化学式为 D .
D .  的稀溶液中存在
的稀溶液中存在
最近更新



