常见金属的冶炼方法 知识点题库
①FeTiO3+H2=Fe+TiO2+H2O;
②TiO2+2C+2Cl2=TiCl4+2CO;
③TiCl4+2Mg=2MgCl2+Ti
下列叙述正确的是( )
(1)青铜是铜和锡的合金,青铜属于 材料(填“金属”或“非金属”或“合成”).
(2)铁锅被广泛使用,主要是利用铁具有 性.
(3)现代炼铁工业是利用一氧化碳把铁从铁矿石里还原出来,该反应的化学方程式为 .
(4)人类利用铜铁铝的先后顺序与金属的活动性有密切关系,用两个实验即能验证铜铁铝的金属活动性顺序:①在硫酸铝溶液中插入铁丝.② (用化学方程式表示).
(1)下列用品中,主要利用金属导电性的是 (填字母代号).
A.铂金饰品 B.铁锅 C.铝导线
(2)人类向自然界提取量最大的金属时铁,高炉炼铁的原料是铁矿石、空气、石灰石和 .
(3)铝的活动性比铁强,但在生活中常在铁的表面涂上铝粉.其原因是
(4)金属钴(Co)与铁具有相似的化学性质.CoCl2固体是蓝色的,CoCl2溶液是粉红色的.现将金属钴投入稀盐酸中,发生反应的化学方程式为Co+2HCl═CoCl2+H2↑,该反应的实验现象为 .
-
(1) 人类向自然界提取量最大的金属是(写化学式),高炉炼铁的原理是铁矿石、空气、石灰石和(写名称);写出高温下一氧化碳把铁从赤铁矿石中还原出来的化学方程式.
-
(2) 铝的金属活动性比铁强,但在生活中常在铁的表面涂上铝粉,其原因是.
-
(3) 金属钴(Co)与铁具有相似的化学性质,CoCl2固体是蓝色的,CoCl2溶液是粉红色的.现将金属钴投入到足量的稀盐酸中,发生的化学反应为Co+2HCl═CoCl2+H2↑.该反应的实验现象为,,.
-
(4) 用Fe、Ag和(写化学式)溶液可以一次性验证Fe、Cu、Ag三种金属的活动性顺序,写出反应的化学方程式.
-
(1) 金刚石、石墨的组成相同,但性质却有很大差异,原因是
-
(2) 工业炼铁原理的化学方程式是;
-
(3) 气态化石燃料燃烧的化学方程式是.
-
(1) I.铁的应用
①下列铁制品的利用与金属导热性有关的是(填字母,下同).
A.铁钳 B.铁锅 C.刀具
②“纳米α﹣Fe粉”可以用于食品保鲜,称之为“双吸剂”,因为它能吸收空气中的.
-
(2) II.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来.请回答下列问题:
①写出以赤铁矿为原料,在高温下炼铁的化学方程式:;
②高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能;
-
(3) Ⅲ.实验探究炼铁原理:
工业上炼铁的原理是利用一氧化碳和氧化铁的反应.某化学兴趣小组利用如图装置进行实验探究,请按要求填空:

①A处发生的现象分别是
②实验过程中,CO的作用有(填序号)
a、CO气体作为反应物
b、实验开始时,排尽装置中的空气,防止加热时发生爆炸
c、停止加热后,防止A中生成物被氧化
d、停止加热后防止B中的溶液倒吸入A中
e、对B中反应物起到一定的搅拌作用,便于CO2与反应液充分接触而反应
③为了防止溶液倒吸,本实验停止加热前是否要先断开A和B的连接处?(填“需要”或“不需要”),理由是.
④为了回收利用一氧化碳,需除去尾气中的二氧化碳,并将剩余气体收集在集气瓶中,c处酒精灯换作下列装置中的最为合理.
⑤实验时准确称取4.8克纯净的Fe2O3固体按图进行实验,当固体全部变黑后,继续通入CO直到玻璃管冷却.将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生.

查阅资料:a.铁的氧化物在足量的稀盐酸中均能全部溶解.
b.Fe2O3与CO反应的固体生成物可能情况如下:
Fe2O3
 Fe3O4
Fe3O4  FeO(黑色)
FeO(黑色)  Fe
Fe根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;②FeO③.
小明称取了反应后的固体,为4.64克,试通过计算确认固体的成分.(写出计算过程)
⑥反思:一氧化碳还原氧化铁的实验中,若要得到铁可采取的措施有(写一种)
-
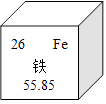
(1) 图1是铁元素在元素周期表中的相关信息,则铁元素的原子序数为.
-
(2) 铁在空气中锈蚀,实际上是铁跟等物质作用,发生一系列复杂的化学反应,转化为铁的化合物的过程.
-
(3) 图2所示的某“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,使用过程中是能转化为热能.

-
(4) 工业上可用磁铁矿(主要成分是四氧化三铁)炼铁,其主要反应原理是(用化学方程式表示).
-
(1) 选择下列适当的物质填空(填字母序号):
A.碳纤维 B.碳酸氢钠 C.糖类 D.聚乙烯
①用于食品包装;②属于复合材料的是;③大米中富含的营养物质;④用于治疗胃病的是。
-
(2) 煤、石油、天然气三大化石燃料都是(填“可再生”或“不可再生”)能源,干电池能量转化效率高,它是一种将能转化为电能的装置,太阳能热水器运行成本低,能实现(填“光—电”或“光—热”)转换。
-
(3) 燃烧含硫化石燃料会产生二氧化硫,请写出硫在空气中燃烧的化学方程式。大量二氧化硫释放到空气中,会导致雨水的pH(填“大于”或“小于”)5.6,形成酸雨。
-
(4) 铁是应用最广泛的金属。
①喷漆能防止铁生锈,原因是。
②工业炼铁时,一氧化碳和赤铁矿(主要成分是氧化铁)发生的主要反应的化学方程式为。
-
(5) 水是生命之源。
①生活中既能降低水的硬度,又能杀菌消毒的方法是。
②含氮的物质进入水中会造成水中藻类大量繁殖,使水体富营养化,导致水质恶化。这里的“氮”是指(填序号)。
A.元素 B.原子 C.离子 D.分子

-
(1) 早晨醒来她吃早餐。
①早餐食物中有花卷、牛奶、鸡蛋和苹果,其中富含维生素的是。
②牛奶中含有丰富的钙元素,如果缺乏会引起。
-
(2) 她出发了。
①她携带的物品中,主要材料属于有机合成材料的是(填字母序号)。
②背包中她还携带了治疗胃酸过多的药物小苏打,写出小苏打与胃酸反应的化学方程式。
-
(3) 在路上,她发现我市正大力推行“清洁能源”工程。
①煤改气是指将传统的燃煤改成燃烧天然气,天然气的主要成分是甲烷,甲烷燃烧的化学方程式为,天然气、煤、统称为化石燃料。
②为保护环境防治雾霾,我市大力推动清洁能源的发展。以下为清洁能源的是。

-
(4) 走进平谷的万亩桃花林中,她闻到了阵阵花香,是因为分子。
-
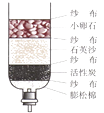
(5) 她在游览时自带的水喝完了,她在路边发现了一条小河河水很浑浊而河边的一个小水坑里的水却很清澈。小河与水坑之间的砂石的作用是,她想到了用如图所示自制净水器来净化小坑里的水,其中活性炭的作用是。她又联想起电解水实验,反应的化学方程式为。
-
(6) 她走进景区。游览了著名的天云山玻璃栈道,锻炼了胆量。玻璃的主要成分是SiO2 , 其中Si元素的化合价为。
-
(7) 在游览中她看到了一座铁索桥。
①联系所学金属冶炼的知识,提出了下列问题:
工业上用一氧化碳和赤铁矿炼铁的原理是(写化学方程式)。
建造这座桥大约用了112吨铁,理论需要氧化铁吨。
②走过铁索桥后她发现有位游客不小心擦伤了手,她赶快拿出自带的碘酒帮其消毒。碘酒是将碘溶解在酒精中制得碘的酒精溶液,碘酒中的溶剂是。
-
(8) 临近中午她饿了,她打开了自带的即热饭盒,其内部结构如图所示。需要加热食物时,让盒内的水与生石灰接触即可,此反应的化学方程式为。
-
(9) 游玩归来,她看新闻。
使用尿素处理尾气可使重型柴油车达到国IV排放标准。其原理是尿素[CO(NH2)2]与汽车尾气中的氮氧化物(如二氧化氮)反应,生成无污染的气体排出。
①尿素属于肥。
②尿素中碳氢元素质量比:。
③补全尿素与二氧化氮反应的化学方程式:4 CO(NH2)2 + 6NO2
 4CO2 + 8H2O + 。
4CO2 + 8H2O + 。

-
(1) 比较强的鼓风系统在炼铁中主要作用是。
-
(2) 请写出工业炼铁的化学方程式。
-
(3) 炼铁得到的生铁属于铁的合金,是(混合物或纯净物)。
-
(1) 新型材料纳米级铁粉具有广泛的用途,它比普通铁粉更易与氧气反应,其制备的主要流程如下图所示。

高温反应器中反应的化学方程式为。反应前需向反应器中通入氮气,目的是。
-
(2) 根据如下图金属应用实例推断,金属具有的物理性质有, (至少答两点)。

-
(3) 生铁和钢都是铁的合金,二者性能不同的原因是。
-
(4) 为探究铝、铜的金属活动性顺序,某同学选用了下列药品进行实验,其中可行的是______(填字母)。A . 铝丝、铜丝、氯化镁溶液 B . 铝丝、铜丝、硫酸铜溶液


-
(1) 用赤铁矿石炼铁的反应原理的是。(用化学方程式表示)
-
(2) 分析工艺流程,三脱装置中S和Si发生反应的化学方程式是。(写一个)
-
(3) 向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验室中的作用(填一种仪器的名称)。
-
(1) 金属的化学性质主要是由金属的活动性决定的。

用如图①②所示实验证明铝的活动性比铜强,观察到的现象是,反应的化学方程式为;用图中③实验可以直接证明铝比铜活泼,则X和Y溶液分别是;
-
(2) 某同学用如图装置,进行还原氧化铁的实验(图中夹持已略去),检查装置气密性,加入药品,在装置中充满二氧化碳后进行实验。

①缓缓通入CO2 , 点燃A处酒精喷灯,加热一段时间,硬质玻璃管中发生反应的化学方程式为。
②点燃B处酒精喷灯,加热一段时间后B处玻璃管内观察到的实验现象是,硬质玻璃管中发生反应的化学方程式为。
③请解释储气装置C中收集到的气体及这些气体有剩余的原因是。
④该实验说明具有还原性
-
(3) 工业上利用赤铁矿炼铁的过程如图所示:

炼铁原料的选择:图中缺少的炼铁原料是,我们一般选择赤铁矿(主要成分Fe2O3)而不用黄铁矿(主要成分FeS2)来炼铁,原因是;高炉炼铁的产物:将高炉气体的主要成分补充完整,高炉炼铁的产物还有;
-
(4) 为了探究钢铁锈蚀的条件,取4枚洁净无锈的铁钉,分别放入4支试管中如图所示:

为了证明铁生锈需要同时接触水和氧气,我们必须进行的实验是(填序号,下同);若要证明其他条件相同时,有氯化钠存在会加速铁的锈蚀, 需要进行的实验是;
-
(5) 保护金属资源人人有责,我们保护金属资源的有效途径主要是:
①合理开釆,寻找替代品;②防止金属锈蚀;③等。
-
(1) 铝合金被广泛应用于制造飞机、高铁等,因为铝合金具有(写一点即可)、密度小等特性。
-
(2) 钪(Sc)合金是比铝合金更轻的合金。相同条件下,取金属钪和锌分别与相同浓度的盐酸反应,钪表面产生气泡的速率明显更快。根据上述现象,判断下列说法正确的是(填序号)。
a. 将Sc投入CuSO4溶液中有红色物质析出
b.用Fe(NO3)2溶液、Sc(NO3)3溶液、Zn能验证钪和铁的活动性强弱
c.用Fe、Sc、稀H2SO4溶液能验证钪和铁的活动性强弱
-
(3) 铁是目前世界上年产量最高的金属,请写出工业上用CO与赤铁矿反应冶炼铁的化学方程式。
步骤Ⅰ:制备并收集CO2。取一只试管,将制成糊状的CuO用毛笔刷在试管内壁,在试管底部加入少量炭粉,再用该试管收集CO2 , 实验装置如下图。

步骤Ⅱ:用CO还原CuO。将步骤Ⅰ收集满CO2的试管套上气球,按下图组装。实验过程中用酒精灯先加热炭粉,再加热氧化铜,观察实验现象。

根据上述实验装置和操作,回答下列问题:
-
(1) 为了收集干燥、纯净的CO2 , 步骤Ⅰ装置的连接顺序为:A→→→,制备CO2的化学方程式是,收集CO2时,若导管不伸入试管底部,会导致。
-
(2) 步骤Ⅱ中加热炭粉时,炭粉与CO2的反应属于基本反应类型中的反应。再加热氧化铜时,1 min左右观察到黑色固体变为紫红色,此时发生反应的化学方程式为。
-
(3) 实验结束后,挤压气球使气体进入试管,取下气球,立即在试管口放置点燃的酒精灯,其目的是。
-
(1) 工业炼铁的原料之一是焦炭,其作用是(写一条)。铁矿石一般选用赤铁矿(主要成分为Fe2O3)等,而不选用黄铁矿(主要成分为FeS2)的理由是、。(写两条)
-
(2) 下图为实验室中模拟炼铁的实验装置。一氧化碳还原Fe2O3的化学方程式为。装置B中的试剂是。从安全角度考虑,点燃酒精喷灯前,需要收集从装置B排出的气体并;安全后,点燃尾气,若发生回火(火焰进入装置)现象,原因是。


-
(1) 空白方框处应填写的物质是什么?。
-
(2) 炼铁时焦炭的作用有两个,一个是提供能量,另一个是什么?。
-
(3) 写出反应3的化学方程式。

回答下列问题:
-
(1) 操作a的名称是。
-
(2) 反应Ⅱ的化学方程式为
 。X、Y表示两种物质,Y的化学式为。
。X、Y表示两种物质,Y的化学式为。
-
(3) 反应I的化学方程式为。



