还原反应及其应用 知识点题库
“化学﹣﹣我们的生活,我们的未来.”
(1)“化学为人类改善环境.”汽车尾气处理装置能使某些有毒气体转化为无毒气体:2NO+2CO N2+2CO2 , 其还原剂是 .
N2+2CO2 , 其还原剂是 .
(2)“化学为人类提供动力.”我国发射“嫦娥三号”的长征三号乙火箭工作时化学反应方程式:C2H8N2+2N2O4 2CO2+3x+4H2O,其中物质x的化学式为 .
2CO2+3x+4H2O,其中物质x的化学式为 .
(3)“化学为人类提供新材料.”信息技术需要使用硅晶片,单质硅是由石英固体(SiO2)与碳在高温条件下反应制成的,同时生成一种可燃性气体,该反应的化学方程式为 .
-
(1) 已知H2、CO、C是初中化学常见的还原剂,请分析下列反应:
H2+CuO
 Cu+H2O 3CO+Fe2O3
Cu+H2O 3CO+Fe2O3 2Fe+3CO2 C+O2
2Fe+3CO2 C+O2 CO2
CO2得出的结论是:物质(如H2、CO、C)作还原剂时,所含元素中,一定有元素的化合价在反应后 (选填“升高”或“降低”或“不变”).
-
(2) 依据上述结论,则在反应SO2+2H2S=3S+2H2O中作为还原剂的物质是 ;该还原剂中所含元素化合价的变化是 .
在C+2CuO ![]() 2Cu+CO2↑反应中,还原剂是( )
2Cu+CO2↑反应中,还原剂是( )
(1)煤燃烧生成的CO2、SO2、CO等气体中,会引起温室效应的是 ;溶于水会形成酸雨的是 ,将煤块粉碎成煤粉后燃烧更加充分,原因是 .
(2)为减少温室气体排放,人们积极寻找不含碳元素的燃料.经研究发现氨气(NH3)燃烧的产物没有污染,且释放大量能量,有一定应用前景.NH3中氮元素和氢元素的质量比为 ;氨气在纯氧中可以完全燃烧,只生成水和氮气,反应的化学方程式是 .
(3)目前,在汽车尾气系统中安装催化转化器可将污染物CO、NO在催化剂的作用下转化为无毒的CO2和N2 , 化学方程式为 ,请根据“在化学反应规程中有元素化合价变化的化学反应,叫做氧化还原反应”判断,该反应 (填写“是”或“不是”)氧化还原反应.
 2MgO+C,该反应中被氧化的物质是( )
2MgO+C,该反应中被氧化的物质是( )

 CaO+CO2↑和水分解的反应可放在②位置
D . 3CO+Fe2O3
CaO+CO2↑和水分解的反应可放在②位置
D . 3CO+Fe2O3  2Fe+3CO2是氧化还原反应可放在③位置
2Fe+3CO2是氧化还原反应可放在③位置
 CaO+CO2↑
B . HCl+KOH═KCl+H2O
C . CO2+H2O═H2CO3
D . 2Na+2H2O═2NaOH+H2↑
CaO+CO2↑
B . HCl+KOH═KCl+H2O
C . CO2+H2O═H2CO3
D . 2Na+2H2O═2NaOH+H2↑
 H2+CO
H2+CO 在这个反应中,还原剂是;发生还原反应的物质是.
A.C; B.H2;C.CO; D.H2O.
 3N2+ 4H2O,其中作还原剂的物质是( )
3N2+ 4H2O,其中作还原剂的物质是( )
已知已知H2、CO、C是初中化学常见的还原剂,H2、CO、C都可以与金属氧化物(如氧化铜)发生反应,请分析下列反应:
①H2+CuO  Cu+H2O
Cu+H2O
②CO+CuO  Cu+CO2
Cu+CO2
③C+2CuO  CO2↑+2Cu
CO2↑+2Cu
-
(1) 在①中:氢元素的化合价由反应前的价变成反应后价,同理分析,在②③两个反应中,CO、C中的碳元素在反应后化合价(选填“升高”或“降低”或“不变”)。
-
(2) 依据上述分析,则在反应SO2+2H2S=3S↓+2H2O中作为还原剂的物质是。

-
(1) 位置4发生的化学方程式是。
-
(2) 本实验存在一处明显缺陷,请给出优化建议(写出一点即可)。
-
(3) 位置5处观察到的实验现象是。

-
(1) 生铁和钢都是铁的合金,其性能不同的原因是。
-
(2) 生活中能很容易辨别出铜丝,依据的是,金属都可拉成丝状,利用了金属的。
-
(3) 汽车轮穀一般用铝合金材料而不用普通钢材的原因是。如图金属应用的实例,主要利用金属的导热性的是(填序号)。
-
(4) 考古工作者发现铁制的出土文物往往锈蚀严重,铁生锈的条件是接触。用一氧化碳和磁铁矿石(主要成分是Fe3O4)炼铁,其反应的化学方程式是。
-
(5) 工人师傅切割铁板时,常用硫酸铜溶液在铁板上画线即可留下红色的印迹,此过程中发生反应的化学方程式为。
 ,其中表现出还原性的物质是( )
,其中表现出还原性的物质是( )

-
(1) 分离液态空气可得到合成氨所需要的氮气,此过程属于变化(填“物理”或“化学”)。
-
(2) 制取氢气的反应过程为:C+H2O
 CO+H2、CO+H2O
CO+H2、CO+H2O  CO2+H2.上述两个化学反应中具有还原性的物质有(填化学式)。
CO2+H2.上述两个化学反应中具有还原性的物质有(填化学式)。
-
(3) 写出N2、H2反应生成NH3的化学方程式。上述流程中可循环利用的物质是。
 2Fe+3CO2 , 其中CO体现还原性。下列化学反应中有物质体现还原性的是( )
2Fe+3CO2 , 其中CO体现还原性。下列化学反应中有物质体现还原性的是( )
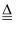 Cu+H2O
C . CuSO4+BaCl2=BaSO4↓+CuCl2
D . H2SO4+2NaOH=Na2SO4+2H2O
Cu+H2O
C . CuSO4+BaCl2=BaSO4↓+CuCl2
D . H2SO4+2NaOH=Na2SO4+2H2O



