金属活动性的探究 知识点
(1)依据在自然界中存在,如以单质存在的金属活动性小于以化合物形式存在的金属
(2)依据与氧气反应的条件及现象:如常温下与氧气能发生反应的金属活动性大于点燃或加热条件下反应的金属
(3)依据金属是否与酸发生反应
(4)依据金属是否与盐溶液反应
金属活动性的探究 知识点题库
小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的。他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动:
【查阅资料】铬(Cr)是银白色有光泽的金属,在空气中表面能生成抗腐蚀性的致密氧化膜。铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液……
铝是银白色有光泽的金属,能与稀硫酸反应,生成无色的硫酸铝溶液……
【预 测】三种金属在金属活动性顺序中的相对位置关系:
①Cr Al Cu ②Al Cr Cu ③Al Cu Cr
【实验过程】取大小相同的三种金属薄片,用砂纸打磨光亮。
| 实验一 | 实验二 | 实验三 | |
| 实验 方案 |  |  |  |
| 实验 现象 | 铬片表面产生气泡缓慢,溶液变蓝色。 | | 铝片表面产生气泡较快。 |
| 结论 | 铬能和稀硫酸发生反应,反应速率较慢。 | 铜不与稀硫酸反应 | |
| 三种金属在金属活动性顺序中的相对位置关系是 | |||
-
(1) 用砂纸打磨金属片的目的是
-
(2) 实验一所发生反应的化学方程式是
-
(3) 小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是
-
(4) 小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是
铁片 铜片 稀硫酸 FeSO4溶液 CuSO4溶液
-
(1) 利用上述药品,你最多可以设计 种实验方案.
-
(2) 请选择一种实验方案叙述如下: .
[实验现象] .
[化学方程式] .
[实验结论] .
选项 | 目的 | 操作 | 现象 | 结论 |
A | 比较铝和铜的金属活动性 | 将砂纸打磨过的铝丝 浸入硫酸铜溶液中 | 铝丝表面有铜析出 | 铝比铜活泼 |
B | 检验露置在空气中的氢氧化钾溶液是否变质 | 取少量氢氧化钾溶液,滴入澄清石灰水 | 有白色沉淀产生 | 氢氧化钾溶液已经变质 |
C | 探究物质溶解于水的热量变化 | 向一定量的水中加入 硝酸铵晶体,充分搅拌 | 溶液温度下降 | 盐类物质溶于水都 能使溶液温度下降 |
D | 检验集气瓶中是否集满二氧化碳 | 将燃烧的木条伸入集气瓶中 | 木条火焰熄灭 | 集气瓶中已集满二氧化碳 |
①地壳中含量最多的金属元素是。
②“沙里淘金”说明黄金在自然界以(填“游离态”或“化合态”)形式存在。
③铜在空气中会生成铜锈[成分是Cu2(OH)2CO3],根据铜锈的主要成分中含有氢元素,可判断铜生锈需要空气中的。
④某小组为探究银、铜、铁的金属活动性顺序,设计了三个实验:a.将铁片浸入稀硫酸中;b.将银片浸入稀硫酸中;c.将铁片浸入硫酸铜溶液中。
I.实验a中反应的化学方程式为。
II.上述三个实验还不能完全证明三种金属的活动性顺序,请补充一个实验来达到实验目的(写出实验操作和现象)。根据以上探究,三种金属的活动性由强到弱的顺序是。
⑤向一定量铜锌混合粉末中逐滴加入稀硫酸,下列图像能正确表示对应变化关系的是。
A.
 B.
B. 
C.
 D.
D. 
选项 | 实验目的 | 实验方案 |
A. | 证明某气体是一氧化碳 | 将该气体通入灼热的氧化铜粉末,黑色粉末变红 |
B. | 证明酸和碱恰好中和 | 向含有酚酞的氢氧化钠溶液中加入盐酸,溶液最终呈无色 |
C. | 证明燃烧的条件之一是可燃物与氧气接触 | 将白磷放入80℃热水中,不燃烧,通入氧气后白磷燃烧 |
D. | 证明金属的活动性顺序为Fe>Cu>Ag | 将两根光亮铁丝分别伸入硝酸银和硫酸铜的溶液中,硝酸银溶液中的铁丝表面有银白色固体附着,另一铁丝表面有红色固体附着 |

-
(1) 乙试管中反应的化学方程式为;
-
(2) 同学们经讨论后认为该方案可以优化,试管的实验是多余的,并通过观察实验现象,得出三种金属的活动性由强到弱的顺序为
-
(3) 去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后,过滤,得到滤渣和滤液,然后对滤渣的成分进行如下探究:
【提出问题】烧杯中滤渣的成分是什么?
【实验探究】向过滤得到的滤渣中加稀硫酸,①若无气泡产生,则滤渣的成分是;②若有气泡产生,则滤渣中一定含有。
实验甲:Mg、Zn、Fe、Cu分别与10%的盐酸反应 
实验乙:金属与盐溶液的作用 
-
(1) 甲组实验中判断金属活动性强弱的依据是,得出的金属活动性由强到弱的顺序为。
-
(2) 乙组实验中得出的金属活动性由弱到强的顺序为。
-
(3) 在甲乙两组实验中不发生反应的实验是(填试管的序号)。
-
(4) 反思与评价:若甲组实验中②④改用10%的稀硫酸,①③仍用10%的稀盐酸进行实验,(填“能”或“不能”)保证得出同样准确的实验结论?乙组实验中只需选择其中的2个就可以得出正确的实验结论,其中必须进行的一个实验是(填试管的序号),发生反应的化学方程式为。
[查阅资料]铁的活动性比铜强。
-
(1) [进行猜想]对三种金属的活动性顺序做出如下猜想:
猜想一: R>Fe>Cu;
猜想二:
猜想三: Fe>Cu>R
-
(2) [收集证据]为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
主要操作
主要现象
实验结论
甲
将打磨好的R丝插入盛有硫酸铜溶液的试管中
猜想一正确
乙
将粗细相同打磨好的R丝、铁丝,分别插入体积和溶质质量分数都相同的稀盐酸中
R 丝表面产生气泡速率比铁丝表面产生气泡速率(填“快”或“慢”)
丙
将粗细相同打磨好的R丝、铁丝,分别在空气中点燃
R 丝在空气中剧烈燃烧,铁丝在空气中不燃烧
写出铁丝与稀盐酸反应的化学方程式。
-
(3) [交流反思]三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
[归纳总结]他们总结得出比较金属活动性强弱的常见方法有:
①金属与氧气反应的难易和剧烈程度;
②金属与酸溶液是否反应或反应的剧烈程度;
③金属与是否反应。
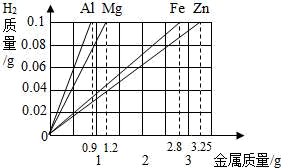
A 四种金属与酸反应的速率:Al>Mg>Fe>Zn
B 四种金属的活动性顺序:Mg>Al>Zn>Fe
C 同质量的四种金属与足量酸反应得到氢气的质量:Mg>Al>Fe>Zn
D 同质量的Al、Mg、Fe、Zn四种金属与足量酸反应得到氢气的质量比:。

-
(1) 该实验方案中所有金属均已打磨,且形状、大小以及稀硫酸的质量、浓度均相同.
甲、乙实验得出Zn 的金属活动性比Fe强,依据的实验现象是:.
-
(2) 甲、乙两个实验无法得出两种金属与另外一种金属的活动性强弱,小聪同学补充设计了丙实验来证明,他发现X片表面有红色固体析出,则X、Y可能分别是,反应的化学方程式为.
-
(3) 实验得出Fe、Cu、Zn三种金属由弱到强的金属活动性顺序为.
-
(4) 小亮也设计了一套实验方案来证明Fe、Cu、Zn三种金属的活动性顺序,他选择的药品不可能是________.A . Zn片 Cu片FeSO4溶液 B . Cu片FeSO4溶液ZnSO4溶液 C . Fe片 Zn片 Cu片H2SO4溶液 D . Fe片ZnSO4溶液CuSO4溶液
(进行实验)
取10支试管,分别加入大小相同的光亮铜片,配制不同浓度的盐酸和硫酸分别倒入试管,浸没铜片,用酒精灯加热(其中倒入盐酸的试管中:加一层石蜡油液封,用小火持续加热,使盐酸处于微沸状态30 min)。
|
硫酸浓度% |
17 |
63 |
65 |
81 |
98 |
|
现象 |
加热20min,铜表面光亮 |
加热20min,铜表面光亮 |
加热15min,铜表面变黑 |
加热5min,铜表面变黑,10min后反应剧烈 |
加热1min,铜表面变黑,3min后反应剧烈 |
|
铜片表面都有气泡产生,有刺激性气味,溶液变为蓝色 |
|||||
|
盐酸浓度% |
12 |
14 |
16 |
27 |
37 |
|
现象 |
溶液无色,铜片没有变化 |
溶液几乎呈无色,铜片没有变化 |
溶液呈很淡的黄色,铜片没有变化 |
溶液呈淡黄色,铜片表面有极细小的极少气泡 |
溶液呈明显的黄色,铜片表面气泡明显 |
-
(1) (解释与结论)
浓硫酸稀释时的操作是。
-
(2) 盐酸加热时,用石蜡油液封的目的是。
-
(3) 由实验得出,盐酸与铜不反应的浓度范围是。
-
(4) 铜与81%的硫酸反应后的溶液变为蓝色,原因是。
-
(5) (反思与评价)
铜与98%硫酸反应生成的气体为SO2铜与37%盐酸反应产生的气体是否为同一种气体,并说明理由:。
-
(6) 从金属活动性角度解释,铜与17%的稀硫酸不反应的原因是。
实验编号 | 1 | 2 | 3 | 4 |
实验操作 |
|
|
|
|
实验后,同学们按老师要求将废液都倒在指定的大烧杯中,小科猜想该烧杯中的废液可能有硫酸铜、硫酸锌、硫酸亚铁⋯,应该可以从中提炼出铁和铜。经思考后,他设计了如图所示的实验,并设法使滤液甲和乙所含的溶质相同。

-
(1) 实验中所加的过量金属粉末是(写名称),则固体C是(写化学式)。
-
(2) 操作③的名称是。
-
(3) 试写出①中的一个反应原理。
-
(4) 探究Zn、Fe、Cu三种金属的活动性顺序,下列试剂的选择方案可行的是____。A.Zn、FeSO4溶液、CuSO4溶液A . Zn、FeSO4溶液、Cu B . ZnSO4溶液、Fe、CuSO4溶液 C . ZnSO4溶液、FeSO4溶液、Cu







