饱和溶液和不饱和溶液 知识点题库
已知CaCO3+H2O+CO2=Ca(HCO3)2 , Ca(HCO3)2可溶于水。下列关于图像的描述不正确的是()
A . 图①表示澄清石灰水中持续通入CO2
B . 图②将镁条和锌片(均足量)分别和等质量、等质量分数的稀硫酸混合
C . 图③表示氢氧化钠溶液中加入大量的水
D . 图④表示将饱和硝酸钾溶液恒温蒸发水份后溶液中溶质的质量分数
饱和溶液是指( )
A . 在一定温度下,一定量的溶剂中不能再溶解该种溶质的溶液
B . 浓度较大的溶液
C . 还能再溶解该种溶质的溶液
D . 不能继续溶解其它溶质的溶液
下列曲线能正确表达对应的反应或过程的是( )
A . 向一定量的水中加入生石灰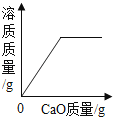 B . 红磷在装有空气的密闭容器中燃烧
B . 红磷在装有空气的密闭容器中燃烧 C . 向一定质量的烧碱溶液中滴入盐酸
C . 向一定质量的烧碱溶液中滴入盐酸 D . 向饱和KNO3溶液中加入KMnO4固体
D . 向饱和KNO3溶液中加入KMnO4固体
 B . 红磷在装有空气的密闭容器中燃烧
B . 红磷在装有空气的密闭容器中燃烧 C . 向一定质量的烧碱溶液中滴入盐酸
C . 向一定质量的烧碱溶液中滴入盐酸 D . 向饱和KNO3溶液中加入KMnO4固体
D . 向饱和KNO3溶液中加入KMnO4固体
20℃时,将等质量的a、b两种固体分别放入到盛有100g水的烧杯中,充分搅拌后,现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙.

回答下列问题:
-
(1) 图甲中一定为饱和溶液的是固体的溶液.
-
(2) 图乙中一定为不饱和溶液的是固体的溶液;
-
(3) 图丙中,M表示固体的溶解度曲线;
-
(4) 当溶液由20℃升温至50℃时,a、b溶液的溶质质量分数(选填“相等”或“不相等”)
兴趣小组的同学看到实验室有一瓶FeSO4、CuSO4混合溶液的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如图实验方案.结合实验方案回答下列问题:

-
(1) 最终得到硫酸亚铁晶体时剩余的溶液是 (选填序号).A . 饱和溶液 B . 不饱和溶液
-
(2) 步骤②中,加入过量稀硫酸的目的是.
-
(3) 在进行“步骤①”、“步骤②”的操作时,可将反应物倒入中(填仪器名称),然后(填操作名称),使反应充分进行.
下列四个图象,分别对应四种操作过程,其中正确的是( )
A .  向盐酸中不断加水
B .
向盐酸中不断加水
B .  一定质量的镁在密闭的容器内燃烧
C .
一定质量的镁在密闭的容器内燃烧
C .  等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
D .
等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
D .  某温度下,向一定质量的饱和氯化钠溶液中加入氯化钠固体
某温度下,向一定质量的饱和氯化钠溶液中加入氯化钠固体
 向盐酸中不断加水
B .
向盐酸中不断加水
B .  一定质量的镁在密闭的容器内燃烧
C .
一定质量的镁在密闭的容器内燃烧
C .  等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
D .
等质量的铁和镁同时分别放入两份溶质质量分数相同的足量稀盐酸中
D .  某温度下,向一定质量的饱和氯化钠溶液中加入氯化钠固体
某温度下,向一定质量的饱和氯化钠溶液中加入氯化钠固体
工业上,通过如下转化可制得KClO3晶体.

-
(1) KClO3中氯元素的化合价为.
-
(2) 生产中所用NaCl溶液由粗盐水精制而成,精制时除去粗盐水中泥沙,采用的操作是.
-
(3) 完善I中反应的化学方程式:NaCl+3H2O
 NaClO3+3.
NaClO3+3.
-
(4) 已知NaClO3+KCl=NaCl+KClO3 , Ⅱ中析出晶体后的滤液是KClO3的(填“饱和溶液”或“不饱和溶液”).
-
(5) 上述流程中,可循环利用的物质是.
下列四个图象中,能正确表示对反应变化关系的是( )
| |
|
|
A.向一定量稀盐酸中加水稀释 | B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C.加热一定量的高锰酸钾固体 | D.向盐酸和氯化镁的混合溶液中加氢氧化钾溶液 |
A . A
B . B
C . C
D . D
下列各项不能正确反映对应变化关系的是( )
A .  电解水
B .
电解水
B .  某温度下向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C .
某温度下向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C .  木炭在密闭容器中燃烧
D .
木炭在密闭容器中燃烧
D .  t1℃时A,B物质的饱和溶液中溶质质量分数相等
t1℃时A,B物质的饱和溶液中溶质质量分数相等
 电解水
B .
电解水
B .  某温度下向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C .
某温度下向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C .  木炭在密闭容器中燃烧
D .
木炭在密闭容器中燃烧
D .  t1℃时A,B物质的饱和溶液中溶质质量分数相等
t1℃时A,B物质的饱和溶液中溶质质量分数相等
甲、乙两种固体物质的溶解度曲线如图所示:

-
(1) 20℃时,等质量的甲、乙分别溶于水形成饱和溶液,溶液质量大小关系是甲(填“>”、“<”或“=”)乙;
-
(2) 将40℃时乙的饱和容液变为不饱和溶液的方法有;
-
(3) 将40℃时150g甲的饱和溶液降温到20℃,所得溶液中溶质质量分数为。
如图是a、b、c三种固体物质的溶解度曲线。据图回答下列问题。

-
(1) P点表示的含义是。
-
(2) 将相同质量t2℃时的a、b、c饱和溶液的温度降低到t1℃时,析出晶体最多的是。
-
(3) t2℃时,将40g a物质放入盛有50g水的烧杯中,所得溶液的质量为。
下表是氯化钠和硝酸钾的部分溶解度(单位:g/100g水),请回答。
|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
|
氯化钠 |
35.7 |
36.0 |
36.6 |
37.3 |
38.0 |
|
硝酸钾 |
13.3 |
32.0 |
63.9 |
110.0 |
169 |
①20℃,在100克的水中最多溶解硝酸钾克,硝酸钾属于(填“易溶”或“可溶”)物质。
②把硝酸钾饱和溶液变成不饱和的一种方法是。
③20℃,36克氯化钠放入50克水中,得到溶液的质量克,在此溶液中加入高锰酸钾,溶液变成紫红色,此时溶液(填“一定”或“可能”)是高锰酸钾的不饱和溶液。
④从含有169克硝酸钾和20克氯化钠的固体混合物中提取硝酸钾。下列操作不需要的是 。

对上述实验后分析正确的是。
Ⅰ.提取的固体中一定有硝酸钾,可能有氯化钠
Ⅱ.提取硝酸钾固体32克
Ⅲ.提取固体后的溶液中,硝酸钾32克,氯化钠20克
Ⅳ.提取固体后的溶液中,硝酸钾137克,氯化钠20克
下列关于溶液说法正确的是( )
A . 任何饱和溶液升高温度都会变为不饱和溶液
B . 把20%的食盐溶液均分成两份,每份溶液的溶质质量分数为10%
C . 向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D . 配制100g10%的氯化钠溶液一般经过计算、称量(或量取)溶解装瓶存放等步骤
配制硝酸钾溶液时得到下表数据,根据表中数据分析,错误的是()
| 序号 | 温度/℃ | 水的质量/g | 所加硝酸钾的质量/g | 所得溶液的质量/g |
| ① | 28 | 10 | 4 | 14 |
| ② | 28 | 10 | 6 | 14 |
| ③ | 60 | 10 | 8 | 18 |
A . 28℃时10g水中最多能溶解硝酸钾4g
B . 60℃时等质量水中能溶解的硝酸钾比28℃时多
C . ①②所得溶液一定都是硝酸钾的饱和溶液
D . ③所得溶液一定是硝酸钾的饱和溶液
下列各项的两种说法中,均正确的是( )
A . 溶液一定是均一、无色、稳定的;溶液中的溶质以分子或离子的形式均匀分散在溶剂中
B . 分离液态空气获得大量氧气属于分解反应;空气污染指数越大,空气质量越好
C . 用定量的方法研究空气成分的化学家是拉瓦锡;氧气可用于钢铁冶炼和金属焊接
D . 海水晒盐属于蒸发结晶;饱和溶液的质量分数一定大于不饱和溶液
如图表示对一杯氯化钠溶液进行恒温蒸发的过程,丙、丁溶液中析出部分氯化钠固体。下列说法错误的是( )

A . 甲溶液一定是不饱和溶液
B . 甲、乙两杯溶液中的溶质质量一定相等
C . 整个实验过程中氯化钠的溶解度保持不变
D . 烧杯中溶液的溶质质量分数大小关系为:丁>丙>乙>甲
类推是学习化学的一种重要方法,以下类推正确的是( )
A . 饱和溶液一定是浓溶液,则不饱和溶液一定是稀溶液
B . 金属元素有正化合价,因此非金属元素一定没有正化合价
C . 物质都是由元素组成的,同种元素可以组成纯净物,则不同种元素也可以组成纯净物
D . 原子和分子均是构成物质的微观粒子,在化学变化中原子不能再分,则分子也不能再分
将纯净的氯化钠固体配制成溶液。20℃时,向4个盛有50g水的烧杯中,分别加入一定质量的氯化钠并充分溶解。4组实验数据如表:下列分析错误的是( )
| 实验序号 | ① | ② | ③ | ④ |
| 加入氯化钠的质量/g | 10 | 15 | 20 | 25 |
| 溶液质量/g | 60 | 65 | 68 | 68 |
A . ①②所得溶液时20℃时氯化钠的不饱和溶液
B . ③④所得溶液的溶质质量分数相等
C . 20℃时,氯化钠的溶解度为36g
D . 20℃时,往②所得溶液加入2g氯化钠,溶液达到饱和
对盛有100g水的烧杯进行如图1所示的操作(其中X是甲、乙、丙中的一种);图2所示是甲、乙、丙三种物质的溶解度曲线。下列分析正确的是( )
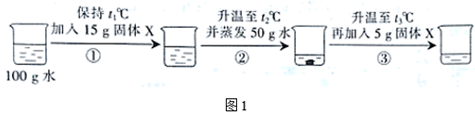
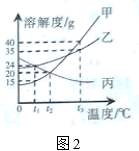
A . 固体X是物质乙
B . 步骤②中未溶解固体的质量为10g
C . 步骤③所得溶液为不饱和溶液
D . 三个步骤所得溶液中溶质的质量分数:③>②>①
下图是某实验小组的同学绘制的两种固体物质的溶解度曲线图。请你根据图示回答问题:

-
(1) t1℃时,a物质的溶解度 b 物质的溶解度(填“>”、“<”或“=”)。
-
(2) 将t2℃时a、b两种物质相同质量的饱和溶液,分别冷却到t1℃,析出晶体最多的是 物质。
-
(3) 溶解度曲线图中的任何一点都表示溶液的一种特定状态。图中A、B两个状态中,溶液属于不饱和状态的是 ,状态最不稳定的是 。
最近更新







