饱和溶液和不饱和溶液 知识点题库
| 温度 (℃) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| KNO3 | 13.3 | 20.9 | 32 | 45.8 | 64 | 85.5 | 110 | 138 | 169 | 202 | 246 |
| NaCl | 35.7 | 35.8 | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
(1)以上两种物质溶解度的变化受温度影响较小的是 。
(2)30℃时,KNO3的溶解度是 g/100g水。
(3)KNO3溶液中含有少量NaCl时,可通过 的方法提纯。
(4)对③析出的晶体和剩余溶液描述正确的是 (填写编号)。
A.剩余溶液一定是KNO3饱和溶液
B.剩余溶液一定是NaCl不饱和溶液
C.上述方法可以将两者完全分离
D.析出的晶体中只含有KNO3
(5)在一定温度下,将含69gKNO3、18gNaCl的混合物完全溶解在50g水中。改变温度只使KNO3析出,则温度T(℃)的范围是 (硝酸钾和氯化钠溶解度互不影响)。


-
(1) 你认为烧杯中的溶液可能是不饱和溶液.
-
(2) 如图是甲、乙两种物质的溶解度曲线图,据图分析,10℃时A烧杯和C烧杯中未溶解的溶质质量关系是(填“相等”或“不想等”).其他条件不变,将C烧杯中的温度升到30℃时,C烧杯中的溶液是(填“饱和”或“不饱和”)溶液.

-
(1) 室温时,(选填“甲”、“乙”或“丙”)溶液可能是不饱和溶液.
-
(2) 图2中能表示乙物质的溶解度曲线的是(填“a”、“b”或“c”,下同),
-
(3) t2℃时,甲、乙、丙三种物质的等质量的饱和溶液中水的质量由大到小的顺序是
-
(4) 小强同学要在实验室配制15%的氯化钠溶液50g.需要氯化钠的质量为克,该同学按图3所示步骤依次操作:其中操作错误的步骤是(填字母);若图3A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为克.

-
(1) 这三种物质的溶液中,适用于海水晒盐原理进行结晶提纯的是.
-
(2) 在t2℃时,将质量均为25g的上述三种物质分别加入到100g水中,不能形成饱和溶液的是.
-
(3) 在t2时,将足量的三种物质的饱和溶液各蒸发10g水后再冷却到t2 , 它们析出晶体的质量分别为m(A)、m(B)和m(C),则三者的大小关系是.
-
(4) 将t2℃的这三种物质的饱和溶液分别降温至t1℃,所的溶液中溶质的质量分数分是ω(A)、ω(B)和ω(C),则三者的大小关系是.
-
(1) 下列做法不合理的是(填序号).
①严格监管化肥和农药的使用
②积极探索污水处理的新技术
③不间断地放水洗衣服
-
(2)
利用如图所示的简易装置可把海水转化为淡水.下列说法错误的是(填序号).


a.小容器中的水为淡水
b.大溶液中得到的溶液一定是氯化钠的饱和溶液
c.获得淡水的快慢与温度有关
-
(3) 市售“自热米饭”的加热原理:饭盒夹层中的水与生石灰接触,反应发出大量热.该反应的化学方程式为.
-
(4) 自来水厂生产自来水的过程中,常加入,用来吸附水中一些溶解性的杂质,除去臭味.

温度/℃ | 0 | 20 | 40 | 60 | |
溶解度 g/100g水 | 甲 | 13.3 | 31.6 | 63.9 | 110 |
乙 | 35.7 | 36.0 | 36.6 | 37.3 | |
丙 | 0.18 | 0.16 | 0.14 | 0.12 | |
-
(1) 0℃时,甲乙丙溶解度最大的物质是。
-
(2) 甲、乙溶解度相等时的温度范围是 。
-
(3) 20℃时S乙=36.0 g/100g水的含义是。
-
(4) 甲固体中混有少量乙,提纯甲的操作是:加水溶解 →→→过滤、洗涤、烘干。
-
(5) 将60℃的甲、乙、丙饱和溶液分别降温到0℃,下列说法正确的是 。
a.均为0℃时的饱和溶液 b.析出晶体质量:甲>乙>丙
c.0℃溶液的溶质质量分数:乙>甲>丙
 加水稀释NaOH溶液
B .
加水稀释NaOH溶液
B .  一定温度下,向一定量的不饱和KNO3溶液中加入KNO3固体
C .
一定温度下,向一定量的不饱和KNO3溶液中加入KNO3固体
C .  向一定量的Na2SO4溶液中滴加BaCl2溶液
D .
向一定量的Na2SO4溶液中滴加BaCl2溶液
D .  在密闭容器中,镁带燃烧前后固体质量的变化
在密闭容器中,镁带燃烧前后固体质量的变化


-
(1) 用化学符号填空:
标出新型净水剂高铁酸钠(Na2FeO4)中Fe的化合价;
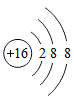 微粒的符号。
微粒的符号。 -
(2) 如图中实验操作或方法正确的是(填序号)。
A
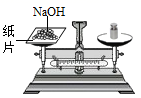 称量NaOH固体
称量NaOH固体B
 检查装置气密性
检查装置气密性C
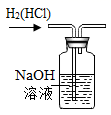 除去H2中的HCl
除去H2中的HClD
 测溶液的pH
测溶液的pH -
(3) 向Cu(NO3)2、AgNO3和Mg(NO3)2的混合溶液中,加入一定质量的金属Zn,充分反应后过滤,得到滤渣和滤液。
①若向滤液中加入稀盐酸,无现象,则滤液中一定含有的金属离子是(填离子符号)。
②若滤液为蓝色,则滤渣中可能含有的金属是。
-
(4) 在t℃时,分别取甲、乙两种固体的溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出的晶体不含结晶水)。

①t℃时,在O点乙的溶液是溶液(填“饱和”或 “不饱和”)。
②t℃时,甲、乙的溶解度大小关系为:甲乙(填“<”“>”或“=”)。
探究I:将足量的碳酸钠、氯化钠和硝酸钾三种物质分别溶解在一定量的水中,溶解过程的温度变化如下图所示。

探究II:
|
实验 |
① |
② |
③ |
|
现象 |
固体溶解, 形成紫红色溶液 |
固体溶解,形成紫红色溶液 |
固体几乎不溶解 |
探究III: 探究过程如下图所示:

回答下列问题:
-
(1) 探究I中,溶解过程放出热量的物质是。
-
(2) 对探究II中实验现象进行分析,需要做的对比是。分析得出的结论之一是。
-
(3) 探究III中,所得溶液一定属于饱和溶液的是。通过该探究得出的结论是(答一点即可)。
-
(4) 在上述探究的基础上,同学们想通过探究,比较食盐和氯化铵在水中的溶解度大小,探究方案应该是。
-
(1) 21世纪重要的金属材料是。
-
(2) 洗涤剂除油脂的原理是能使植物油在水中分散成无数细小油滴,而不再聚集成大油珠,使油和水不再分层,形成的,乳化后的细小液滴能随水流动。

-
(3) 碘酒中溶剂的化学式是。

-
(4) 铁锈的主要成分为(填化学式)。
-
(5) 读图

①是池,此时池中溶液是氯化钠的(“饱和”或“不饱和”)溶液。

⑴溶质质量分数;⑵溶液的密度;⑶溶解度;⑷溶剂的质量;⑸溶液的体积



